 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Механизмы транспорта через мембрану
Поверхностная клеточная мембрана (плазмалемма) — основной барьер для транспорта молекул в клетку и из клетки. Строение и состав мембраны обусловливают ее универсальные свойства: полупроницаемость и асимметричность. Транспорт растворенных веществ через мембрану практически полностью происходит с участием интегральных белков. Кроме того, свойства мембраны обеспечивают возникновение и поддержание электрического мембранного потенциала. Изучение процесса поглощения ионов и понимание того, как вещества переносятся через мембрану, включает две основные проблемы: первая — каковы движущие силы, источники энергии для транспорта; вторая — что из себя представляют сами системы переноса через мембраны, как они действуют и регулируются.
Движущие силы транспорта. Движущая сила переноса ионов на расстояние х — градиент электрохимического потенциала Δ  (или Δ
(или Δ  /dx) (см. гл. 2).
/dx) (см. гл. 2).
Существует два основных типа транспорта через мембрану: пассивный, при котором растворенное вещество движется по градиенту электрохимического потенциала без использования дополнительной энергии; и активный, сопряженный с тратой энергии (например, АТФ или пирофосфата), которая используется для перемещения ионов против градиента электрохимического потенциала.
Ион пассивно входит в клетку, если  out >
out >  in, где индексы out и in указывают на внешнюю и внутреннюю стороны мембраны соответственно. Когда
in, где индексы out и in указывают на внешнюю и внутреннюю стороны мембраны соответственно. Когда  in >
in >  out, то ион движется пассивно из клетки. Движение продолжается до установления равновесия, когда
out, то ион движется пассивно из клетки. Движение продолжается до установления равновесия, когда  in =
in =  out.
out.
Если в равенство  in =
in =  out поставить уравнение электрохимического потенциала
out поставить уравнение электрохимического потенциала
(RTlnCout + z Fψout = RTlnCin + zFψin) и преобразовать его, то получим уравнение Нернста:
(ψout – ψin)= EN =  , (6.1)
, (6.1)
где разность потенциалов наружной и внутренней стороны мембраны (ψout - ψin) представляет потенциал Нернста (EN). При выражении символами уравнение Нернста аналогично уравнению Доннана (рис. 6.11). В уравнении Нернста EN предсказывает величину электрического потенциала (мВ), когда его градиент уравновешивает различия в химическом потенциале по обе стороны мембраны. Ионы могут двигаться пассивно в результате действия движущих сил, возникающих из разниц химического потенциала ( ), обусловленного концентрационной асимметрией, и/или разниц электрического потенциала (-∆Е). В соответствии с принципами термодинамики градиент электрического потенциала энергетически может перекрывать градиент химического и тогда поступление иона внутрь будет идти пассивно, даже если Cin > Cout.
), обусловленного концентрационной асимметрией, и/или разниц электрического потенциала (-∆Е). В соответствии с принципами термодинамики градиент электрического потенциала энергетически может перекрывать градиент химического и тогда поступление иона внутрь будет идти пассивно, даже если Cin > Cout.
Уравнение Нернста можно использовать как критерий оценки характера транспорта некоторых катионов и анионов. У корней гороха (Pisum sativum), которые поглощали ионы из питательного раствора с известной концентрацией, были измерены мембранный потенциал и концентрация ионов в тканях (табл. 6.1).
Таблица 6.1. Измеренные и предсказанные как равновесные концентрации
ионов (мM • л-1) в тканях корней гороха (P. sativum), имеющих мембранный
потенциал -110 мВ (по Higinbotham et al., 1967)

Подставив значения измеренного ∆Е иконцентрации ионов в среде в уравнение Нернста, можно найти «равновесную» концентрацию ионов в тканях.
Из сравнения рассчитанных (равновесных) и действительных (измеренных) концентраций ионов в тканях были сделаны следующие выводы: 1) распределение К 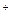 между раствором и корнями гороха практически равновесное; 2) Са
между раствором и корнями гороха практически равновесное; 2) Са  , Mg
, Mg  , Na
, Na  транспортируются пассивно, но их концентрация в тканях значительно ниже (особенно, для Са
транспортируются пассивно, но их концентрация в тканях значительно ниже (особенно, для Са  ), чем равновесная, рассчитанная по уравнению Нернста; это предполагает либо исключительно низкую проницаемость мембраны для этих ионов, что маловероятно, либо активный механизм их выкачивания из клетки; 3) анионы транспортируются активно, а поскольку различия мембранного потенциала отрицательны относительно внутреннего компартмента и концентрация анионов в корне выше, чем снаружи, их поглощение идет активно, против градиентов и электрического, и химического потенциалов.
), чем равновесная, рассчитанная по уравнению Нернста; это предполагает либо исключительно низкую проницаемость мембраны для этих ионов, что маловероятно, либо активный механизм их выкачивания из клетки; 3) анионы транспортируются активно, а поскольку различия мембранного потенциала отрицательны относительно внутреннего компартмента и концентрация анионов в корне выше, чем снаружи, их поглощение идет активно, против градиентов и электрического, и химического потенциалов.
Основной вклад в создание электрического потенциала на клеточных мембранах (плазмалемме, тонопласте, мембране ЭР) вносят диффузионный потенциал (Ed), который является результатом пассивного транспорта ионов, и электрогенный потенциал (Еp), возникающий вследствие активного (с использованием энергии) выкачивания протона.
Диффузионный потенциал обусловлен разницей в проницаемости мембраны (Р) для катионов и анионов, что приводит к различиям в величине потоков ионов через мембраны. Если по обе стороны мембраны (в отсеках «А» и «Б») находится раствор с разной концентрацией КО (рис. 6.12) и мембрана более проницаема для К+, чем для Сl  (Р
(Р  > P
> P  ), то диффузия К+ из отсека «А» (концентрация КС1 100 мМ) в отсек «Б» (концентрация 1 мМ) будет происходить быстрее, чем СГ. В течение короткого времени быстрое перемещение К+ и относительно медленное СГ приведет к небольшому разделению зарядов и накоплению на поверхности мембраны в отсеке «А» слабо диффундирующего аниона, а на поверхности в отсеке «Б» — катиона. Вследствие этого на мембране возникает отрицательный электрический потенциал (-∆Е). В живой клетке количество заряда, которое должно разделиться для возникновения ∆Е -100 мВ (типичная величина для плазмалеммы), ничтожно мало по сравнению с суммой положительных и отрицательных зарядов в цитоплазме: по расчетам достаточно присутствия одного лишнего аниона снаружи на каждые 100 000 в клетке. Образование ∆Е замедляет перемещение К+ и даже приводит к некоторому обратному выходу К+ в отсек «А».
), то диффузия К+ из отсека «А» (концентрация КС1 100 мМ) в отсек «Б» (концентрация 1 мМ) будет происходить быстрее, чем СГ. В течение короткого времени быстрое перемещение К+ и относительно медленное СГ приведет к небольшому разделению зарядов и накоплению на поверхности мембраны в отсеке «А» слабо диффундирующего аниона, а на поверхности в отсеке «Б» — катиона. Вследствие этого на мембране возникает отрицательный электрический потенциал (-∆Е). В живой клетке количество заряда, которое должно разделиться для возникновения ∆Е -100 мВ (типичная величина для плазмалеммы), ничтожно мало по сравнению с суммой положительных и отрицательных зарядов в цитоплазме: по расчетам достаточно присутствия одного лишнего аниона снаружи на каждые 100 000 в клетке. Образование ∆Е замедляет перемещение К+ и даже приводит к некоторому обратному выходу К+ в отсек «А».

Рис. 6.12. Возникновение диффузионного потенциала (Ed) при разной проницаемости
(Р) мембраны для катиона и аниона (Р  > P
> P  ):
):
а — исходная система электронейтральна; б — возникает -∆Е; при равновесии потоков через
мембрану между ее наружной (А) и внутренней (Б) поверхностью электрический потенциал
мембраны соответствует диффузионному потенциалу Ed; стрелки — градиенты химических и
электрического потенциалов и их направления
Когда градиент электрического потенциала достигает некоего постоянного уровня, нетто-перемещение К из «А» в «Б» прекратится. Разность концентраций, которая может со-
храниться ([Кд] > [Kg]), уравновесится градиентом электрического потенциала, названного диффузионным — Ed. Поскольку СГ также перемещается через мембрану, то стационарный градиент концентрации К+ (А[К+]) и Ed будут ниже, чем в случае, когда диффузии аниона не происходит. Величина Ed может быть рассчитана из уравнения Гольдмана, где Р — коэффициент проницаемости:
 . (6.2)
. (6.2)
Итак, величина Ed является функцией концентрации ионов в растворе и проницаемости мембраны, и уравнение Гольдмана позволяет описать вклад пассивных ионных потоков и Ed в общий мембранный потенциал.
Поддержание трансмембранного электрического потенциала обеспечивается также процессом активного переноса через мембрану протона (Н+). Выкачивание Н+ осуществляют протонные помпы — интегральные белки мембран, проявляющие гидролитическую активность. Работа
Н+-помпы сопряжена с использованием энергии, которая поставляется главным образом за счет гидролиза АТФ. В этом случае выкачивание Н+ и создание электрогенного потенциала Ер связаны с функционированием Н+-АТФаз (рис. 6.13).

Рис. 6.13. Образование электрогенного потенциала (Ер) на плазмалемме (ПМ) и тонопласте (ТП) с участием Н+-АТФазы
Обычно у растений на плазмалемме поддерживается градиент (цитозоль → апопласт) отрицательного электрического потенциала в пределах от -120 до -160 мВ (возможны вариации от -100 до -300 мВ), и на внутренней (цитозольной) стороне мембраны потенциал более отрицательный, чем на внешней. На тонопласте ∆Е (вакуоль → цитозоль) в среднем составляет +30 мВ (меняется от 10 до 70 мВ), и внешняя сторона тонопласта, так же как у плазмалеммы, имеет более отрицательный заряд.
Электрогенный потенциал (Ер) вместе с диффузным (Ed) обеспечивают создание на плазмалемме суммарного градиента электрического потенциала (∆Е). При этом вклад Ер в суммарную величину мембранного потенциала у растений составляет более половины, что гораздо больше, чем у животных, у которых основной вклад в ∆Е плазмалеммы вносит диффузионный потенциал (90 — 95 %).
У всех биологических мембран потенциал регулируется внутри ограниченных пределов, что важно по ряду причин. Обычный цитозоль-отрицательный потенциал плазмалеммы обеспечивает движущую силу для пассивного (электрофоретического) транспорта ионов против их химического потенциала. Мембранный потенциал играет ключевую роль в некоторых системах клеточной сигнализации. Деполяризация мембраны (сдвиг -∆Е в сторону более положительных значений), вызванная некоторыми воздействиями, приводит, например, к активации Са  -каналов, являющихся компонентами путей передачи информации (см. подразд. 3.4.3). Кроме того, уровень потенциала на мембране должен поддерживаться в пределах, активирующих электрогенную помпу (Н+-АТФазу), которая удаляя из цитозоля метаболически продуцируемый Н+, стабилизирует рН цитозоля и обеспечивает движущую силу для активного поступления ионов. При активации Н+-АТФазы мембрана может гиперполяризоватъся, т.е. ее потенциал станет еще более отрицательным. Некоторые ионные каналы активируются в этих условиях, выполняя определенные функции в тех или иных физиологических процессах (см. подразд. 3.5.3).
-каналов, являющихся компонентами путей передачи информации (см. подразд. 3.4.3). Кроме того, уровень потенциала на мембране должен поддерживаться в пределах, активирующих электрогенную помпу (Н+-АТФазу), которая удаляя из цитозоля метаболически продуцируемый Н+, стабилизирует рН цитозоля и обеспечивает движущую силу для активного поступления ионов. При активации Н+-АТФазы мембрана может гиперполяризоватъся, т.е. ее потенциал станет еще более отрицательным. Некоторые ионные каналы активируются в этих условиях, выполняя определенные функции в тех или иных физиологических процессах (см. подразд. 3.5.3).
Н+-помпы мембран растительной клетки. У растений наиболее весомый вклад в энергизацию мембран вносят три типа помп: Н+-АТФаза плазмалеммы (ПМН+-АТФаза), выкачивающая Н+ из клетки, и Н+-АТФаза (VН+-АТФаза) и пирофосфатаза (Н+-ПФаза) на тонопласте, которые вытесняют Н+ из цитозоля в вакуоль (рис. 6.14).
Н+-помпы могут быть идентифицированы по их гидролитической активности, связанной с использованием АТФ или пирофосфата (ФФН). Белок Н+-помп составляет 1 — 5 % от очищенного белка мембран, что выше, чем для каких-либо других транспортных белков. Возможно, их обилие в мембранах компенсирует низкую скорость транспорта протонов, которая составляет около 100 ионов в секунду или менее (котранспортеры переносят 300 —1000 ионов/с, а через каналы могут переносится 106—108 ионов/с).
Н+-АТФаза плазмалеммы. Этот комплекс представлен единственным полипептидом с молекулярной массой 100 кД и относится к Р-типу АТФаз, образующих в ходе реакции промежуточный фосфорилированный продукт (аспартил фосфат). Субстратом для
ПМН+-АТФазы служит МgАТФ и константа Михаэлиса Кт варьирует у растений от 0,3 до 14 мМ; оптимум рН около 6,6. Мономер образует 10 интегрированных в мембране доменов, а с цитозольной стороны между 4-м и 5-м доменами — гидролитическую петлю, на которой находится АТФ-связывающий участок (рис. 6.14). Стехиометрия удаления Н+ и гидролиза АТФ (Н+/АТФ) равна единице.
Механизм протонного транспорта с участием этой помпы еще окончательно не выяснен. Каталитический цикл, обеспечивающий выкачивание Н+, предполагает следующую ступенчатую последовательность: связывание Н+ и на участке D — Mg-АТФ, затем образование высокоэнергетического продукта (аспартил фосфата) и высвобождение АДФ; как следствие этих реакций происходят конформационные изменения фермента, которые приводят к высвобождению Н+ с наружной стороны плазмалеммы; возвращение фермента после высвобождения Фн в исходное состояние. Работу этой помпы ингибирует ванадат. Предполагают, что он имитирует Фн, и связывание ванадата в активном центре блокирует переход фермента в исходное активное состояние.

Рис. 6.14. Предполагаемые структурные модели Н+-помп растительной клетки (модификация по: Sze et al., 1999; Morsomme, Boutry, 2000; Rutajczak, 2000; Maeshima, 2001):
/ — Н+-АТФаза плазмалеммы (ПМН+-АТФаза): 1 —10 — участки полипептидной цепи, пересекающие ПМ; D — каталитический участок, содержащий аспартатный остаток, связывающий Mg-АТФ; AID — автоингибиторный домен
С-конца, который вследствие фосфорилирования
протеинкиназой и присоединения 14-3-3-белка переводит ПМН+-АТФазу из неактивной (НАк) в активную (Ак) форму; // — вакуолярная Н+-АТФаза (VН+-АТФаза): V1 — цитозольная, Vo — мембранная части комплекса; A—G — субъединицы V1; a—d — субъединицы Vo. Детали пространственного расположения субъединиц С, Е, F, G, Н и d у
VН+-АТФазы не выяснены (по Maeshima, 2001); ///— вакуолярная пирофосфатаза (Н+-ПФаза): 1 —14 — участки полипептидной цепи Н+-ПФазы, пересекающие мембрану (домены 3, 4 и 8— 13 не представлены); ГП — гидрофильная цитозольная петля между 5-м и 6-м трансмембранными доменами с консервативным сегментом (CS1) и местами связывания субстрата (Mg-ФФн), К+ и Mg 
На посттрансляционном уровне ПМН+-АТФаза регулируется с участием протеинкиназы/протеинфосфатазы и 14-3-3-белка (рис. 6.14, /). В состоянии низкой активности реакционный центр фермента блокирован автоингибиторным доменом, расположенным на С-конце полипептида. Активация Н+-АТФазы осуществляется при последовательных реакциях фосфорилирования и присоединения 14-3-3-белка на автоингибиторном участке. В результате происходят конформационные перестройки, вызывающие перемещение С-конца, и реакционный центр становится доступным для присоединения Mg-АТФ и протона. Давно известен эффект активации ПМН+-АТФазы фузикокцином (токсическое соединение, продуцируемое грибом Fusicoccwn amigdali). Оказалось, что и в этом случае полная активация Н+-АТФазы достигается, если к С-автоингибиторному домену присоединяются не только фузикокцин, но и 14-3-3-белок.
Н -АТФазы плазмалеммы растительных клеток кодируются мультигенным семейством: идентифицировано 10 генов у арабидопсиса (Arabidopsis), 9 у табака (Nicotiana), 7 генов у томата (Lycopersicon) и 5 у бобов (Viciafaba). В ряде случаев разные гены кодируют отдельные изоформы, и высокий уровень их экспрессии коррелирует с накоплением Н+-АТФаз в специфических типах клеток, например клеток корневого волоска (aha2), или флоэмы (aha3), где Н-помпы участвуют в выполнении специфических физиологических функций (поглощение ионов, транспорт Сахаров). Другие Н+-АТФазные гены экспрессируются в клетках многих тканей. Например, ген рта4 табака экспрессируется в клетках эпидермиса корня, в сопровождающих клетках флоэмы и замыкающих клетках устьиц. При действии факторов среды (солевой стресс, низкий ψ  , темнота) уровень экспрессии генов ПМН+-АТФаз также может меняться.
, темнота) уровень экспрессии генов ПМН+-АТФаз также может меняться.
Вакуолярная Н+-АТФаза (VН+-АТФаза) присутствует не только в тонопласте, но и в мембранах эндоплазматического ретикулума (ЭР), аппарата Гольджи, везикулах. VН+-АТФаза отличается от Н+-помпы плазмалеммы по всем основным параметрам, характеризующим свойства и структуру. Прежде всего, это не мономерная полипептидная цепь, а самый большой многосубъединичный белковый комплекс тонопласта с молекулярной массой, по разным источникам, от 650 до 750 кДа. Величина Кт для Mg-АТФ у VН+-АТФазы составляет от 0,1 до 0,2 мМ, т.е. ниже, чем у
ПМН+-АТФазы, а соотношение Н /АТФ, наоборот, выше (от 2 до 3), что свидетельствует о различии их кинетических параметров. Специфические ингибиторы VН+-АТФазы — бафиломи-цин А, конканамицин С и нитрат. При связывании АТФ и выкачивании протона в вакуоль не образуется промежуточного фосфорилированного интермедиата и, таким образом, VН+-АТФаза не относится к АТФазам Р-типа. По своей четвертичной структуре VН+-АТФаза сходна с
АТФ-синтазой F-типа митохондрий и хлоропластов (см. гл. 2) и представлена двумя функциональными частями: цитозольной (V1) и мембранной (Vo) (рис. 6.15, //). Ансамбль V1 где происходит гидролиз АТФ, состоит из 5 —8 типов субъединиц, а интегральная часть (Vo) представлена 3 — 5 типами субъединиц и функционирует, как Н -канал. У разных видов растений выявлено разное количество типов субъединиц и некоторые субъединицы V1 и У0-частей присутствуют в нескольких копиях.
V1-комплекс включает по три повторности субъединиц А и В, которые соответствуют α- и β-субъединицам F-АТФаз и осуществляют каталитическое (А) и некаталитическое (В) связывание АТФ (рис. 6.14, //). Субъединица D, соответствующая γ-субъединице F-АТФазы, выполняет роль связующего стержня между периферийной (V1) и мембранной (Vo) частями. Остальные субъединицы V1-комплекса (от С до Н) выполняют функции стабилизации, поддержания активности, обеспечения контакта и сопряжения работы V1 и У0-частей. Точное пространственное расположение субъединиц С —Н в общем мультигетерогенном ансамбле VН+-АТФазы пока не установлено.
Интегральный V0-комплекс содержит большую (100 кД) субъединицу а, шесть или более субъединиц с (их молекулярная масса равна 16 кД, т. е. вдвое выше, чем у с -субъединиц
F-АТФазы) и субъединицу d (32 — 36 кД) (рис. 6.14, II). Как установлено на дрожжах, взаимодействие между а- и с -субъединицами обеспечивает путь для транспорта протона через мембрану. Данные о связи субъединицы а с комплексом V1—Vo и ее функциях противоречивы. Возможно, она имеет отношение к агрегации комплекса, а не к транслокации Н+, или
a -субъединица функционирует как статор в относительно слабой ассоциации с гексамером из с-субъединиц.
Хотя VН+-АТФаза растений, как и других организмов, ингибируется специфическим токсином бафиломицином А1 субъединица, которая его связывает, не выявлена (у бычьего фермента это субъединица а). Так что, модели структуры растительной VН+-АТФазы, которые имеются в настоящее время, в значительной мере гипотетичны (рис. 6.14, II), а функции отдельных субъединиц часто предположительные. К настоящему времени большинство субъединиц
VH+-АТФазы Arabidopsis (кроме F-13 кД, Н-51 кД, а-100 кД и d~45 кД) клонированы.
Предполагают, что механизм превращения одной формы энергии в другую (АТФ ↔ Δ  ) у
) у
VН+-АТФазы и F-АТФ-синтазы сходен, но реакции, связанные с АТФ, идут в противоположных направлениях. Ротационный механизм катализа сопрягает проводимость протона через Vo (или Fo) с гидролизом АТФ в V1 -комплексе и с синтезом в F1.
Пирофосфатаза (Н+-ПФаза) — помпа, альтернативная VН+-АТФазе, перекачивающая протон из цитозоля в вакуоль (рис. 6.14, ///). Источником энергии для Н+-ПФазы служит пирофосфат (ФФН) — простейшее высокоэнергетическое соединение, и стехиометрия реакции НУФФН равна 1, а скорость транспорта протона ниже, чем у двух других Н+-помп. Н+-ПФаза имеет молекулярную массу 80 — 81 кДа и представлена единственной полипептидной цепью из 14 мембранных доменов и нескольких гидрофильных петель (на рис. 6.14, /// представлены не все домены и только одна петля). N- и С-концы находятся на вакуолярной стороне тонопласта. Функциональный участок находится на цитозольной петле между 5-м и 6-м доменами и включает один из консервативных мотивов (указан как консервативный сегмент CS1), где происходит связывание и гидролиз Mg-ФФH, а также транспорт Н+. Механизм сопряжения этих реакций неясен, но установлено, что важную роль в связывании и гидролизе играют кислые остатки аминокислотной последовательности участка CS1. Активность фермента ингибируется Са  и стимулируется К+ и Mg
и стимулируется К+ и Mg  , для которых имеются сайты связывания. Предполагается, что Са
, для которых имеются сайты связывания. Предполагается, что Са  блокирует реакцию гидролиза пирофосфата магния (Mg-ФФн), заменяя его на пирофосфат кальция (Са-ФФн).
блокирует реакцию гидролиза пирофосфата магния (Mg-ФФн), заменяя его на пирофосфат кальция (Са-ФФн).
Н+-ПФазы клонированы из многих организмов (высших наземных растений, водорослей, фотосинтезирующих бактерий и простейших), но в клетках млекопитающих и дрожжей они отсутствуют.
Функции Н  -помп в растительной клетке. Электрогенные помпы благодаря поддержанию и регуляции электрохимического протонного градиента обеспечивают движущую силу для перемещения веществ через мембрану. Выкачивание Н+ (иначе, первичный транспорт) и генерация Δ
-помп в растительной клетке. Электрогенные помпы благодаря поддержанию и регуляции электрохимического протонного градиента обеспечивают движущую силу для перемещения веществ через мембрану. Выкачивание Н+ (иначе, первичный транспорт) и генерация Δ  ведет к образованию альтернативной к АТФ форме энергии (см. гл. 2), которая может быть использована для активного вторичного транспорта других ионов. Возвращение Н+ через мембрану по градиенту Δ
ведет к образованию альтернативной к АТФ форме энергии (см. гл. 2), которая может быть использована для активного вторичного транспорта других ионов. Возвращение Н+ через мембрану по градиенту Δ  , сопряженное с перемещением через мембрану других веществ (минеральных, органических ионов и нейтральных молекул), обеспечивает их активный транспорт против градиента электрохимического потенциала (рис. 6.15).
, сопряженное с перемещением через мембрану других веществ (минеральных, органических ионов и нейтральных молекул), обеспечивает их активный транспорт против градиента электрохимического потенциала (рис. 6.15).
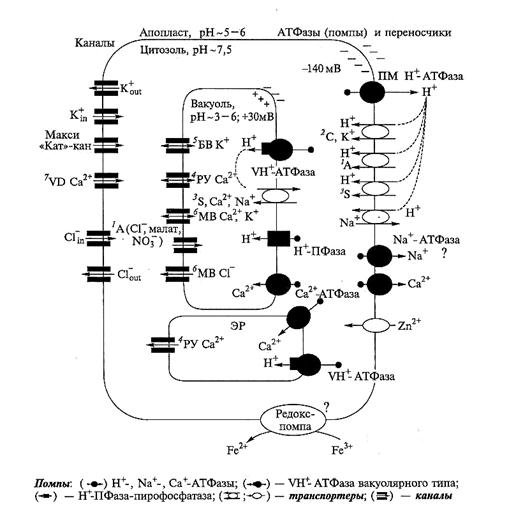
Рис. 6.15. Схема основных систем транспорта ионов через плазмалемму (ПМ), мембраны вакуоли (В) и эндоплазматического ретикулума (ЭР) в растительной клетке.
Справа представлены помпы и транспортеры (1А — анионы; 2С — катионы;  S — органические вещества: сахара, аминокислоты, органические кислоты); слева — каналы (4РУ — рецептор-управляемые каналы; 5БВ и
S — органические вещества: сахара, аминокислоты, органические кислоты); слева — каналы (4РУ — рецептор-управляемые каналы; 5БВ и  MB — быстрые и медленные вакуолярные каналы; 7VD — потенциалзависимый канал; in и out — входной и выходной каналы; макси «кат» — неспецифический Са
MB — быстрые и медленные вакуолярные каналы; 7VD — потенциалзависимый канал; in и out — входной и выходной каналы; макси «кат» — неспецифический Са  , К+ входной канал). Пунктиром показана связь транспорта иона с транспортом Н+ и работой Н+-АТФазы
, К+ входной канал). Пунктиром показана связь транспорта иона с транспортом Н+ и работой Н+-АТФазы
С участием Н+ -помп поддерживается гомеостаз рН в цитозоле, подкисляются вакуолярный сок и среда в клеточной стенке (рис. 6.13 и 6.15), что необходимо для протекания целого ряда процессов, активности ферментов и функционирования транспортных систем. Реализуя свои функции, Н+-АТФазы участвуют в таких физиологических процессах, как устьичные движения, осморегуляция, устойчивость к солевому стрессу и низким значениям рН среды, поступление Сахаров и аминокислот из апопласта в клетки, загрузка флоэмы, клеточный рост и др.
Общая характеристика белков, транспортирующих минеральные вещества. Своеобразный по количеству и качеству состав минеральных элементов в растительных клетках — результат активности специфических интегральных белков мембран, транспортирующих ионы, исходным источником которых является окружающая среда. По своим биохимическим, термодинамическим и молекулярным характеристикам, а также механизмам регуляции системы транспорта ионов могут быть разделены на несколько основных групп: АТФазы, переносчики, или котранспортеры, и каналы (рис. 6.15).
Особая группа АТФаз Р-типа — Са  v -АТФазы. Они присутствуют в плазма-лемме, тонопласте и других мембранах растительной клетки (рис. 6.15). Основная функция Са
v -АТФазы. Они присутствуют в плазма-лемме, тонопласте и других мембранах растительной клетки (рис. 6.15). Основная функция Са  -АТФаз — поддержание низкой концентрации Са
-АТФаз — поддержание низкой концентрации Са  в цитозоле, что необходимо для реализации его роли вторичного мессенджера (см. подразд. 3.4.2). Кальциевые помпы плазмалеммы включены в радиальный транспорт Са
в цитозоле, что необходимо для реализации его роли вторичного мессенджера (см. подразд. 3.4.2). Кальциевые помпы плазмалеммы включены в радиальный транспорт Са  в корнях (см. подразд. 2.3.1).
в корнях (см. подразд. 2.3.1).
У животных в создании и регуляции электропотенциала на клеточной мембране большая роль принадлежит Nа+/К+-АТФазе. У фотосинтезирующих одноклеточных водорослей (но не у высших растений) обнаружена Nа+-АТФаза, которая удаляет Na+ из клетки (см. гл. 8) и так же, как
Са2+-АТФаза, не вносит существенного вклада в поддержание ∆Е на плазмалемме.
Таким образом, для активного перемещения Са2+ и Na+ из цитозоля против их градиентов электрохимического потенциала энергия АТФ используется непосредственно при работе Са2+- и Nа+-АТФаз.
Переносчики, или транспортеры. Концепция переносчиков (carrier) была разработана в 1960-е гг. на основании ставших классическими исследований Э. Эпштейна с соавт. и других научных групп кинетики поглощения ионов клетками водорослей и отсеченными, так называемыми «обессоленными», корнями растений, выращенных на воде или временно перенесенных на воду. Поглощение «обессоленными» корнями рассматривается как поглощение клеткой, при этом проводится аналогия между механизмами поддержания ионного баланса клеткой и целым корнем, в котором апопласт уподобляется стенке клетки, симпласт — цитозолю, а вакуом корня — вакуоли одиночной клетки. Результаты таких исследований были использованы для разработки клеточной модели корня (см. подразд. 6.2.4.2; рис. 6.32). Позднее исследование кинетики поглощения проводили также на выделенных протопластах и сконструированных мембранных везикулах.
Скорость поглощения К+ отсеченными корнями ячменя меняется при изменении концентрации КС1 в растворе, и изотерма поглощения имеет вид гиперболической кривой подобной кривой кинетики насыщения для реакции, катализируемой ферментом (рис. 6.16, А). Поэтому, как и кинетика ферментативной реакции, зависимость скорости поглощения от концентрации иона соответствует уравнению Михаэлиса—Ментен:
 , (6.3)
, (6.3)
где V — наблюдаемая скорость поглощения при концентрации иона [C]out в растворе; Vmax — скорость, достигаемая при выходе на плато, когда увеличение [C]out не приводит к увеличению скорости поглощения (вследствие насыщения связующих мест переносчика); Кт,каж — кажущаяся константа Михаэлиса—Ментен, соответствующая [C]out при достижении  Vmax.
Vmax.
По аналогии с ферментной реакцией Кт, каж характеризует сродство транспортера к иону: чем ниже Кт,каж, тем эффективнее работает переносчик при низких концентрациях ионов в растворе. Vmax отражает (условно) число мест переноса (количество фермента в ферментативной реакции) и определяет возможности системы транспортировать ион при его высоких концентрациях.
При исследовании кинетики поступления были получены двухфазные и даже многофазные кривые, на основании которых были постулированы, а затем и выявлены системы транспорта, достигающие насыщения в разных диапазонах внешних концентраций и с разным сродством к иону (рис. 6.16): механизм I – с небольшой Vmax и высоким сродством (низкая Кт) к иону (высоко-афинные переносчики) и механизм II — с низким сродством (высокой Кт) и высокой Vmах
(рис. 6.16, А), а в ряде случаев (рис. 6.16, Б) с несколькими точками насыщения.

Рис. 6.16. Скорость поглощения как функция концентрации иона в растворе: А — изменение скорости поглощения К+ отрезанными корнями ячменя при низких (7) и высоких (2) концентрациях КСl в среде (Epstein, 1966); Б — многофазная (фазы 1 — 4) кинетика скорости поглощения К+ по механизму II (пунктирная линия — Vmах поглощения по механизму I) (Epstein, Hains, 1965); В — скорость поглощения нитрата диким типом (1) и che 1 мутантом В1 (2) Arabidopsis в зависимости от концентрации NO  в среде (по Daddema, Telkamp, 1979); Г — многофазная кинетика (фазы 1—5) скорости поглощения фосфата из растворов с разной концентрацией; фосфатом снабжали только участок корня кукурузы (по Nandi et al., 1987); Кт — константа Михаэлиса
в среде (по Daddema, Telkamp, 1979); Г — многофазная кинетика (фазы 1—5) скорости поглощения фосфата из растворов с разной концентрацией; фосфатом снабжали только участок корня кукурузы (по Nandi et al., 1987); Кт — константа Михаэлиса
Переносчики перемещают растворенные вещества либо против, либо по градиенту электрохимического потенциала со скоростями 102— 104 ионов в секунду. Однако в зависимости от условий, при которых они исследуются, транспортеры иногда ведут себя как каналы, или, наоборот, каналы ведут себя подобно транспортерам (особенно это касается К+), поэтому различия между ними в настоящее время не совсем ясны. Активное перемещение, или вторичный транспорт, ионов и других веществ происходит одновременно (или в котранспорте) с Н+ и обеспечивается конформационными изменениями транспортирующего белкового комплекса. Котранспорт протона и иона может идти в одном (симпорт) или в противоположном (антипорт) направлениях (см. рис. 6.15). В симпорте с протоном через плазмалемму транспортируются анионы, К+ (при низких концентрациях), а также сахара и аминокислоты. В антипорте с Н+ переносятся Na+ через плазмалемму и тонопласт, а Са2+, сахароза и гексоза через тонопласт. Некоторые переносчики функционируют на плазмалемме в системе унипорта.
Исследование кинетики поглощения К+ отрезанными корнями ячменя из раствора КСl в широком диапазоне концентраций (E.Epstein et al, 1963) показало, что при поступлении К+ как в области низких (< 1 мМ), так и высоких концентраций (>1 мМ) изменение скорости следует кинетике Михаэлиса – Ментен (рис. 6.16). При низкой концентрации поглощение происходит активно (механизм I) и, видимо, в симпорте с Н+ (см. рис. 6.15), а при высокой (механизм II) — пассивно. Первый высокоафинный К+-транспортер НКТ1 (highaffinity К+ transporters 1) был идентифицирован в корнях пшеницы. Другой транспортер К+ из корней AtKUP1 (Arabidopsis taliana K+ uptake) функционирует в зависимости от предшествующих условий выращивания растений (голодание или обеспечение К+) как переносчик с высоким (Кт 44 мкМ) и низким
(Кт 11 мМ) сродством к К+ (см. подразд. 6.3.5).
По градиенту электрохимического потенциала в системе унипорта через мембрану переносится цинк (см. рис. 6.15). Его транспортер идентифицирован у Arabidopsis (ZIP 1 — 4). Экспрессия ZIP1 и ZIP3 в корнях растений, голодающих по цинку дает основание считать, что эти транспортеры участвуют в поглощении Zn2+ из почвы.
Анионы транспортируются против градиента химического потенциала, и концентрация NO  и РО
и РО  в тканях в десятки и даже сотни раз превышает равновесную, предсказанную из уравнения Нернста (см. табл. 6.1). Поглощение анионов имеет ту особенность, что не только низкоафинные, но и высокоафинные переносчики электрогенны, т. е. функционируют в сопряжении с Н+-помпой.
в тканях в десятки и даже сотни раз превышает равновесную, предсказанную из уравнения Нернста (см. табл. 6.1). Поглощение анионов имеет ту особенность, что не только низкоафинные, но и высокоафинные переносчики электрогенны, т. е. функционируют в сопряжении с Н+-помпой.
Поглощение NO  осуществляется транспортерами высокого и низкого сродства и в обоих случаях происходит симпорт 2Н+/ NO
осуществляется транспортерами высокого и низкого сродства и в обоих случаях происходит симпорт 2Н+/ NO  . При низкой концентрации скорость поглощения NO
. При низкой концентрации скорость поглощения NO  соответствует кинетике Михаэлиса—Ментон, достигая насыщения при 0,1 — 0,5 мМ (рис. 6.16, В). При дальнейшем увеличении концентрации скорость опять возрастает. Но у дикого типа Arabidopsis зависимость скорости V как функции от [NO
соответствует кинетике Михаэлиса—Ментон, достигая насыщения при 0,1 — 0,5 мМ (рис. 6.16, В). При дальнейшем увеличении концентрации скорость опять возрастает. Но у дикого типа Arabidopsis зависимость скорости V как функции от [NO  ] в среде гиперболическая, а у мутанта che1 — линейная, что является ярким примером генетического контроля транспортных систем.
] в среде гиперболическая, а у мутанта che1 — линейная, что является ярким примером генетического контроля транспортных систем.
Фосфор транспортируется активно в виде иона Н3РО4 в симпорте с Н+. Концентрация Р в почвенном растворе чрезвычайно низкая (см. рис. 6.2), но может сильно возрастать, например, после внесения удобрений. Растения приспособились использовать фосфор как при низкой, так и при высокой концентрации. Функционируют две системы поглощения Н2РО  : система I с высоким сродством (Кт 3 – 7 мкМ), которая экспрессируется или деэкспрессируется при голодании по фосфору, и система II, представленная конститутивными переносчиками с низким сродством (Кт изменяется от 50 до 350 мкМ), проявляющими многофазность кинетики насыщения в зависимости от концентрации (рис. 6.16, Г).
: система I с высоким сродством (Кт 3 – 7 мкМ), которая экспрессируется или деэкспрессируется при голодании по фосфору, и система II, представленная конститутивными переносчиками с низким сродством (Кт изменяется от 50 до 350 мкМ), проявляющими многофазность кинетики насыщения в зависимости от концентрации (рис. 6.16, Г).
Ионные каналы — большая и разнообразная группа интегральных белковых комплексов, которые присутствуют во всех клеточных мембранах (см. рис. 6.15). Одна из основных функциональных характеристик каналов — их способность распознавать и достаточно селективно, с высокой скоростью (106—108 ион/с) транспортировать ионы. Перемещение ионов по каналу происходит по градиенту  , т. е. пассивно, и основной составляющей движущей силы часто является разность концентраций иона по обе стороны мембраны. Другая особенность каналов — регуляция их пропускной способности в ответ на специфические стимулы. Активность каналов модулируется мембранным потенциалом, рН, концентрацией ионов, внутриклеточными сигнальными молекулами и рядом других эндогенных и экзогенных факторов.
, т. е. пассивно, и основной составляющей движущей силы часто является разность концентраций иона по обе стороны мембраны. Другая особенность каналов — регуляция их пропускной способности в ответ на специфические стимулы. Активность каналов модулируется мембранным потенциалом, рН, концентрацией ионов, внутриклеточными сигнальными молекулами и рядом других эндогенных и экзогенных факторов.
Большой прогресс в исследовании функциональной активности и регуляции ионных каналов был достигнут благодаря разработке метода «пэтч-кламп» (patch clamp). Метод основан на локальной фиксации потенциала на мембране и измерении проводимости тока, которая отражает проницаемость иона через одиночные ионные каналы с использованием протопластов клеток, изолированных вакуолей или везикул выделенных мембран. По признаку ионной специфичности каналы классифицируются по видам переносимых катионов (калиевые, кальциевые) и анионов (хлоридные, малатные) (см. рис. 6.15). При более детальной функциональной систематизации каналов учитываются проводимость и селективность каналов, направление транспорта иона, принадлежность к разным мембранам, способы регуляции, электрические и фармакологические характеристики. При этом основные характеристики, используемые для классификации каналов, транспортирующих тот или иной ион, могут быть разными. Калиевые каналы плазмалеммы подразделяются на входные (inward) и выходные (outward), а калиевые каналы тонопласта — на быстрые (fast) и медленные (slow) в зависимости от скорости их активации (см. рис. 6.15). Кальциевые каналы, участвующие в передаче информации и определяющие специфику кальциевого сигнала (см. подразд. 6.3.4), делятся на потенциал- и рецептор-управляемые и классифицируются по местоположению в мембранах (плазмалемма, тонопласт, эндоплазматический ретикулум) и характеру регуляции. Важные характеристики анионных каналов (исследованы, главным образом, хлорные каналы) — их селективность, направление движения ионов (in, out) и кинетика (быстрые, медленные), а также локализация в мембранах.
Свойство селективности, как правило, не является абсолютным, а отражает преимущественную проводимость определенного иона (при физиологических концентрациях часто близкую к абсолютной). В настоящее время выявлена целая группа неселективных катионных каналов (НСКК — английская аббревиатура NSCC). Среди них наибольший интерес представляют
К+/Са2+-«макси»-катионный канал замыкающих клеток устьиц Viciafaba (см. рис. 6.15), потенциал нечувствительный К+/NН  -канал корней A. taliana и К+/Na+-канал корней пшеницы. Вакуолярный анионный входной канал пропускает Cl-, NO
-канал корней A. taliana и К+/Na+-канал корней пшеницы. Вакуолярный анионный входной канал пропускает Cl-, NO  и малат2+.
и малат2+.
Сложность при классификации каналов связана также с необходимостью совмещать известные электрофизиологические и биохимические характеристики с результатами их идентификации на молекулярном уровне. Например, К+-каналы, согласно их молекулярно-структурным характеристикам (число доменов и гидрофильных петель и др.) (см. рис. 6.18), разделены на четыре типа (семейства). К так называемому «шейкерному» семейству (Shaker family) относят идентифицированные у A. taliana К+-каналы с разными функциями: АКТ1 (Arabidopsis thaliana K+ transporters) экспрессируется в эпидермисе и коре корня и связан с поступлением К+ из среды; КАТ1 (К+ Arabidopsis transporters) переносит К+ в замыкающие клетки устьица, a SKOR (stellar K+ outward rectifier) осуществляет загрузку ксилемы (см. подразд. 2.3.2; 3.5.1).
Ионная специфичность, пропускная способность, характер регуляции и другие свойства канала определяются его структурой. По модели, разработанной главным образом на базе исследования Na+/K+- и К+-каналов животных, ионы перемещаются по специальной структуре — поре, которая имеет полость, заполненную водой, и множество мест связывания (рис. 6.17).

Рис. 6.17. Структурно-функциональные элементы условной модели потенциалзависимого ионного канала.
Изменение положения «воротных» доменов α-субъединиц указано стрелками; (-) и (+) — заряды на участках селективного фильтра и сенсора
Пора формируется отдельными участками полипептидных цепей гомологичных α-субъединиц. Часть поры канала, находящаяся на внешней стороне плазмалеммы, достаточно широкая (не менее 1 нм в диаметре), названа «устьем». Центральная часть гидрофильной поры имеет меньший диаметр («0,7 нм), величина которого варьирует в разных местах. Зона, где находится, так называемый селективный фильтр, — самая узкая часть поры (0,4 — 0,5 нм). Благодаря селективному фильтру пропускная способность калиевого канала для К+ в 100 и более раз выше, чем для Na+. Механизм, который контролирует активность канала, был объяснен с помощью английского слова «gate», для которого в русском варианте был выбран термин «ворота». Управление активностью осуществляется благодаря переходу канала в состояния «открытый — закрытый» (через открывание/закрывание или отпирание/запирание канала) при помощи воротного механизма (рис. 6.17). Регуляция активности потенциалзависимых каналов обеспечивается по крайней мере двумя системами: сенсором потенциала, индуцирующего открывание ворот канала, и системой, которая инактивирует воротный механизм, приводя к закрыванию канала. В обоих случаях происходит обратимое изменение конформации субъединиц на участках поры, составляющих структуру ворот и обеспечивающих функционирование воротного механизма.
Исследования К+-каналов Shaker-типа, проведенные на дрозофиле (Drosophila) и арабидопсисе, стали базой для моделирования механизма активации канала в зависимости от изменения мембранного потенциала и для выяснения взаимосвязи между структурой и функцией. У растений К+-канал Shaker-типа (АКТ1, КАТ1, SKOR) представляет собой гомотетрамер (рис. 6.18, Б), у которого полипептидная цепь каждой из четырех α-субъединиц имеет 6 трансмембранных участков (segments): S1 —S6 (рис. 6.18, Л).

Рис. 6.18. Структура калиевого канала Shaker-типа: А — трансмембранная топология полипептидной цепи: S1—S6 — трансмембранные сегменты;
S4 — сенсорный участок; Н5(Р) — гидрофильная петля; «мяч» — участок с NН3-концевой группой; цНМФ — домен
С-конца, связывающий циклический нуклеотид (например, цГМФ); КHA — домен, обогащенный гидрофобными (Н) и кислотными (А) остатками; Б — тетрамер из четырех α-субъединиц (вид сверху); В — модель тетрамера: стабилизация с помощью КHA-домена; Г — схема активации/инактивации К+-канала Shaker-типа по модели «мяч на привязи»: R (rest) — состояние покоя, О (open) — открытое состояние, I — инактивированное состояние
Сегмент S4 отвечает за восприятие потенциала и контролирует активность канала. Его сенсорные свойства связаны с семью положительно заряженными остатками аминокислот. В субъединице этот домен (S4), реагирующий на изменения мембранного потенциала, окружен другими трансмембранными участками, которые изолируют положительный заряд (рис. 6.18, Б). Между 5-м и 6-м сегментами расположен особый домен — Н5 (helix), или Р (роге). Эта петля формирует часть водной поры и отвечает за проницаемость канала. Но мутации, затрагивающие структуру S6- и S4-S5-петель, показали, что эти участки цепи полипептида тоже связаны с К+-проницаемостью и/или чувствительностью канала к блокирующим ионам. Функциональные участки находятся также на цитозольных N- и С-концах полипептидной цепи (рис. 6.18, А). Одна из моделей регуляции активности Shaker-канала предполагает наличие на N-конце домена («мяча»), осуществляющего открывание/закрывание канала (рис. 6.18, Г). Модель, названная «мяч на привязи», исходит из существования трех состояний канала: покой — R (rest); открытое — О (open) и инактивированное — I. При изменении потенциала в положительную сторону канал открывается (R→ О), что сопряжено с конформационными перестройками, а затем инактивируется вследствие того, что NH3-терминальная группа «мяча» перемещается в пору между
S5 и S6 сегментами субъединиц. На С-конце полипептида имеются домен цНМФ (cNMP), связывающий циклический нуклеотид монофосфат (цГМФ — возможный вторичный мессенджер, регулирующий активность канала), и домен взаимодействия КHA, обогащенный гидрофобными
(Н — hydrophobic) и кислыми (А — acidic) остатками. КHA-домены α-субъединиц отдельного канала или двух соседних каналов могут взаимодействовать, что будет стабилизировать тетрамер (рис. 6.18, В) или приводить к образованию на мембране кластеров из тетрамеров калиевых каналов.
Каналы вносят большой вклад в поступление ряда минеральных веществ, радиальный и дальний транспорт ионов в корне и распределение минеральных элементов в клеточных структурах, тканях и органах. Кроме того, каналы — неотъемлемые участники многих комплексных физиологических процессов, таких, как поддержание и регуляция потенциала на мембране, осморегуляция и солеустойчивость, устьичные движения, а также передача сигнала и ответные реакции на разные внешние воздействия и др.
Поиск по сайту: