 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Пути эффективного использования материальных ресурсов
Основным показателем использования сырья (а также энергии, вспомогательных материалов) является расходный коэффициент, показывающий массу затраченного сырья (вспомогательных материалов) на производство единицы продукции. Как было указано в предыдущем разделе, различают теоретический расходный коэффициент, определяемый из стехиометрического уравнения химической реакции образования продукта из исходных веществ при полном их превращении, и практический (или расходный коэффициент), т. е. реально достигнутый в производстве. Их отношение показывает степень использования сырья [1]:



В большинстве химических производств затраты на сырье составляют значительную часть себестоимости продукции. Концепция полного использования сырьевых ресурсов направлена на максимальный выход целевого продукта, максимальное превращение сырья в применяемые, полезные продукты. Основные пути достижения этой цели следующие.
Комплексное использования сырья. В силу геохимической природы почти все месторождения полезных ископаемых являются комплексными и обычно содержат ряд полезных компонентов, извлечение которых является экономически целесообразным. В месторождениях нефти полезными компонентами являются попутный газ, сера, йод, бром, бор; в месторождениях газа – конденсаты, гелий, сера, азот; в ископаемых углях – метан, колчедан, сера, германий, каолины, бокситы, карбонатное сырье, горный воск; в месторождениях железных руд часто присутствует титан, ванадий, кобальт, цинк, сера, фосфор, иногда германий и нерудные минералы; в месторождениях полиметаллических руд в различных соотношениях находятся олово, медь, никель, кобальт, вольфрам, молибден, золото, серебро, платиноиды и целый комплекс редких металлов.
Рациональное и комплексное использование сырьевых ресурсов предусматривает наиболее полное извлечение из недр полезных ископаемых, максимально возможное извлечение всех ценных компонентов из добытого минерального сырья на всех стадиях его переработки, более полное использование отвалов горных пород и отходов обогатительных фабрик, тепловых электростанций, металлургических и химических производств и охрану окружающей среды.
Комплексная переработка сырья увеличивает степень его использования путем утилизации побочных продуктов и отходов и превращения их в полезные продукты, а также совмещением нескольких производств внутри одного предприятия. Так, при конверсии природного газа получают наряду с водородом (для синтеза NH3) диоксид углерода, который в процессе синтеза NH3 не применяется. Поэтому обычно совмещают производство аммиака с получением карбамида, при котором в качестве сырья используют СО2.
Комплексное использование сырья широко применяется при переработке твердых топлив (угля, сланцев), нефти, руд цветных металлов, горно-химического и растительного сырья. Например, в коксохимической промышленности наряду с коксом получают и другие продукты (коксовый газ, смолу), химическая переработка которых позволяет производить многие органические соединения, а также сырье для азотной промышленности. При переработке нефти, природного и попутного газа можно получить высококачественную серу (99% S) и ряд других продуктов. В России создана научно-техническая и производственная база, способная обеспечить промышленность гелием с чистотой 99,985–99,995%, извлекаемым из природного газа Оренбургского месторождения.
На основе комплексного использования концентратов цветных металлов организовано крупное производство таких металлов, как кадмий, индий, висмут, рений, селен, теллур и также других рассеянных элементов; из отходящих газов цветной металлургии получают серную кислоту (более 25% от всего ее производства). В значительных количествах на предприятиях цветной металлургии попутно производят также суперфосфат, калийные удобрения, медный купорос, диоксид титана, оксид цинка и другие виды химической продукции.
В настоящее время около 40% получаемой серной кислоты производится за счет комплексного использования минерального сырья смежных отраслей (переработка нефти, природного газа и отходящих газов цветной металлургии).
При комплексной переработке апатито-нефелиновых руд, помимо фосфатного сырья, можно получить глинозем, содопродукты, фториды, портландцемент, диоксид титана, соединения редкоземельных элементов.
Рациональное и комплексное использование сырья, включая вторичные ресурсы, имеет важное значение для повышения технико-экономических показателей химического производства. Чрезвычайно важно, что при этом решаются проблемы, связанные с охраной окружающей среды и сохранением экологического равновесия в природе, так как сокращаются выбросы вредных веществ в атмосферу, водоемы, загрязнение недр Земли твердыми отходами.
Выбор способа и технологической схемы производства. Это важнейший этап создания химико-технологического процесса, обеспечивающий эффективность использования сырьевых ресурсов. Так, например, хлорвинил получают в две стадии. Сначала хлорируют этилен, а затем проводят пиролиз образовавшегося дихлорэтана:
СН2=СН2 + Cl2  ClCH2CH2Cl
ClCH2CH2Cl  CH2=CHCl + HCl
CH2=CHCl + HCl
Избирательность каждой стадии составляет около 95%. Образующийся HCl относят к отходам. Выход хлорвинила по этилену равен 90%, по второму исходному веществу (хлору) – 50%.
Перейдя к одностадийной схеме окислительного гидрохлорирования с заменой одного из реагентов (Cl2) на другой (НСl), описываемой уравнением
СН2=СН2 + НCl + О2  CH2=CHCl + Н2О
CH2=CHCl + Н2О
с избирательностью 95%, удалось разработать процесс с 95%-ным выходом продукта по обоим исходным компонентам.
Избыток одного из реагентов, как правило, более дешевого и доступного, а также возможность его возвращения в процесс также приводит к повышению степени использования сырьевых ресурсов. В данном случае применяют два фактора влияния избытка реагента на увеличение выхода продукта.
1. Термодинамический фактор, когда избыток одного реагента увеличивает максимальное равновесное превращение другого. В паровой конверсии метана СН4 + Н2О = СО + 3Н2 стехиометрическое соотношение реагентов СН4: Н2О = 1: 1. В промышленных условиях (Р = 30 атм, Т = 900ºС) равновесная степень превращения метана (х р) для исходной смеси указанного состава достигает значения 0,58. При соотношении СН4: Н2О = 1: 4 (четырехкратный избыток Н2О) х р = 0,92. Это соотношение используется в промышленности.
2. Кинетический фактор связан с особенностями механизма и кинетики протекающего процесса. В реакции окисления аммиака 4NH3 + 5О2 = 4NO + 6Н2О стехиометрическое соотношение реагентов О2: NH3 = 1,25. Реакция протекает во внешнедиффузионной области и лимитируется переносом аммиака к поверхности катализатора – его концентрация у поверхности мала. При стехиометрическом соотношении реагентов смесь аммиака с воздухом будет содержать 14% NH3 и 17,5% О2. Во внешнедиффузионном режиме степень превращения аммиака на поверхности катализатора может достигать 99%. Содержание газов составляет, об. %:
NH3 – 14 ∙ (1 – 0,99) = 0,14; О2 – 17,5 – 1,25 ∙ (14 ∙ 0,99) = 0,17.
В этих условиях NH3 окисляется, в основном, до N2. Необходим избыток кислорода, вытесняющий аммиак с поверхности катализатора, тогда окисление будет протекать преимущественно до NO. Если же использовать соотношение О2: NH3 = 1,8, т. е. в воздушно-аммиачной смеси будет содержаться 10% NH3 и 18% О2, то в этом случае концентрации реагентов на поверхности катализатора будут другими:
 = 10 ∙ (1 – 0,99) = 0,1%;
= 10 ∙ (1 – 0,99) = 0,1%;  = 18 – 1,25 ∙ (10 ∙ 0,99) = 5,6%.
= 18 – 1,25 ∙ (10 ∙ 0,99) = 5,6%.
Концентрация кислорода у поверхности на два порядка превысит концентрацию аммиака, что и обеспечит избирательное окисление аммиака. Именно это и определяет 10%-ное содержание NH3 в аммиачно-воздушной смеси.
Использование избытка одного из реагентов выгодно воздействует на механизм процесса, приводя к образованию целевого продукта, когда возможны побочные параллельные или последовательные реакции. Например, при алкилировании бензола этиленом в присутствии катализатора (AlCl3) процесс может проходить по следующей схеме:
С6Н6  С6Н5–С2Н5
С6Н5–С2Н5  С6Н4(С2Н5)2
С6Н4(С2Н5)2  С6Н3(С2Н5)3
С6Н3(С2Н5)3
+ С6Н6 + С6Н6 + С6Н6
Целевым продуктом является этилбензол. В реакционной системе очень быстро устанавливается состояние равновесия. Положение его зависит от количественного соотношения этилена и бензола. Избыток бензола, через который барботируют этилен, предотвращает образование побочных продуктов.
Реагент, используемый в избытке, должен быть недорогим (например, воздух). Этого правила можно не придерживаться, когда существует возможность рециркуляции избытка реагента, т. е. возращения его в цикл после применения в предыдущем превращении. Например, так используется водород при восстановлении катализатора (Со + ThO2 + MgO) в синтезе бензина по методу Фишера – Тропша. В результате реакции получается смесь Н2 + Н2О. После конденсации водяного пара избыток водорода возвращается на стадию восстановления катализатора.
Противоток веществ. Данный метод является рациональным способом максимального использования исходных веществ в гетерогенных системах (за исключением системы Т – Т), когда фазы не очень измельчены и значительно отличаются по плотности, что способствует быстрому их разделению. Если эти условия соблюдены, можно перемещать в противоположных направлениях потоки различных веществ, между которыми происходит массообмен. Когда какой-либо компонент находится одновременно в двух контактирующих фазах, концентрация его стремится к выравниванию. Наибольшая разность концентраций достигается при противотоке. Таким образом можно проводить многие единичные процессы, например выщелачивание твердых тел, экстрагирование масел из семян или экстракцию в системе Ж – Ж, сорбцию газов, умягчение воды, обжиг руд, промывку осадков и т. д.
Рассмотрим пример – абсорбцию оксидов азота. На рис. 3, показана зависимость равновесных парциальных давлений оксидов азота над раствором HNO3. Для максимального поглощения оксидов азота, которое достигается при их минимальном парциальном давлении, жидкая фаза должна содержать наименьшее количество HNO3. Это осуществляется в абсорбере с противоточным движением фаз (рис. 3).

Рис. 3. Зависимость равновесных парциальных давлений оксидов азота NO х  над раствором HNO3 от ее концентрации
над раствором HNO3 от ее концентрации 
Вверху абсорбера, где подается вода, концентрация кислоты минимальна, и выходящие газы содержат небольшое количество оксидов азота. Здесь поглощение происходит практически полностью. Такое явление используется во всех сорбционных процессах.
Фракционный рецикл. Этотспособ используют при неполном превращении исходных реагентов. В системе разделения, расположенной после реактора, непрореагировавшие реагенты выделяют и возвращают на переработку. Типичный пример, в котором применяется фракционный рецикл, – синтез аммиака, когда после конденсации и сепарации аммиака оставшуюся азотоводородную смесь снова направляют в реактор синтеза. Другой пример: многие процессы нефтехимического синтеза характеризуются образованием большой гаммы продуктов. Последние разделяют в многоколонной системе, а непрореагировавшие компоненты возвращают в систему вместе со свежей смесью. При такой организации процесса с рециклом реагентов превращение исходного компонента в системе будет полным.
Регенерация с рециклом. Данная операция заключается в регенерации вспомогательного материала после его использования с последующим возвращением в процесс. Например, в схеме очистки азотоводородной смеси от СО2 в производстве аммиака используют поглотитель – моноэтаноламин (МЭА). После абсорбции СО2 раствором МЭА последний подогревают и направляют в десорбер (рис. 4). В нем выделяется СО2 и регенерированный раствор возвращают на абсорбцию.

Рис. 4. Технологическая схема выделения СО2 из азотоводородной смеси:
1 – абсорбционная колонна; 2 – рекуперативный теплообменник; 3 – десорбционная колонна;
4 – подогреватель; МЭА – моноэтаноламин; карб. МЭА – карбонизированный моноэтаноламин
В системе ректификации продуктов дегидрирования этилбензола в стирол в колонну отгонки продукта добавляют элементарную серу для предотвращения его полимеризации. Тем не менее полимеризация частично протекает. Ее продукты вместе с серой накапливаются в кубовых остатках ректификации (КОРС). Серу регенерируют растворением в углеводородной среде и последующей ее кристаллизацией при охлаждении до 5−10ºС. Из полимерных продуктов термодеструкцией (мономеризацией) при повышенных температурах (400−450ºС) стирол регенерируют. Регенерация серы и стирола в таком процессе достигает 90−95%.
Утилизация отходов. Тенденция использования побочных продуктов и отходов обусловлена экономикой производства. Однако часто полезный побочный продукт образуется в слишком малом количестве или концентрация этого продукта в смеси настолько низкая, что его трудно выделить.
Наиболее выгодные условия использования побочных продуктов и отходов существуют на большом предприятии, выпускающем взаимосвязанную продукцию. Примером может служить производство аммиака и карбамида на одном заводе. Водород, необходимый для синтеза аммиака, можно получить конверсией метана по следующим реакциям:
СН4 + Н2Опар → СО + 3Н2
СО + Н2Опар → СО2 + Н2
Диоксид углерода поглощается водой в скруббере под давлением 10−30 атм, а водород направляется в установку синтеза аммиака. Вода, выходящая из скруббера, расширяется, выделяя СО2 (побочный продукт), который используется в производстве карбамида. Реакцию синтеза карбамида из аммиака и двуокиси углерода (через карбамат аммония NH4CO2NH2) можно описать суммарным уравнением
2NH3 + CO2  CO(NH2)2 + Н2О
CO(NH2)2 + Н2О
100−200 атм
Полезные продукты можно получать также из непрореагировавших исходных веществ и из примесей, имеющихся в сырье. Так, в производстве аммиака воздух используют как источник азота. Вместе с ним в азотоводородную смесь попадает содержащийся в воздухе аргон. На стадии синтеза аммиака осуществляется фракционный рецикл азотоводородной смеси. Аргон не выводится с аммиаком и накапливается в циркулирующем потоке. Чтобы избежать его значительного накопления, приходится часть потока выводить (отдувка). Выделяя аргон из отходящего газа, в котором его концентрация значительно выше, чем в воздухе, получают дополнительный ценный продукт.
В производстве экстракционной фосфорной кислоты отходом является CaSO4 ∙ 2Н2О, называемый фосфогипсом. Чаще его складируют в отвалы, занимающие большие площади (на образование 1 т продукта расходуется более 2,5 т апатита). В отличие от природного гипса, фосфогипс имеет другую кристаллическую структуру и содержит примеси, в частности фосфорную кислоту. Перекристаллизация этого отхода производства фосфорной кислоты позволяет получать разнообразные строительные материалы, при этом повышается степень использования апатита.
Производство фенола и ацетона кумольным методом включает последовательные стадии синтеза изопропилбензола, гидропероксида изопропилбензола и кислотного разложения последнего на фенол и ацетон:
С6Н6 + СН3СН=СН2 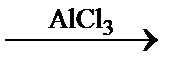 С6Н5СН(СН3)2
С6Н5СН(СН3)2 
 С6Н5С(СН3)2
С6Н5С(СН3)2  С6Н5ОН + СН3СОСН3
С6Н5ОН + СН3СОСН3
|
ООН
Эти превращения сопровождаются значительным образованием фенольной смолы (отхода производства) в количестве 100−200 кг на 1 т фенола. Большинство ценных компонентов, содержащихся в фенольной смоле, можно переработать в дополнительные товарные продукты или использовать в основном технологическом процессе. Утилизация фенольной смолы позволяет извлечь до 85% ценных химических продуктов, при этом в схеме присутствует также фракционный рецикл по изопропилбензолу.
Альтернативное сырье. Переработка невозобновимого сырья заставляет не только искать способы повышения степени использования, но и его замену другими видами сырья. Поэтому первым направлением расширения сырьевых источников является применение отходов других производств, а вторым – поиск альтернативных источников первичного сырья.
Получение сырья для нефтехимической промышленности в основном базируется на двух самых распространенных процессах нефтепереработки – термическом пиролизе (этилен и другие низшие олефины) и каталитическом риформинге (бензол и другие ароматические углеводороды). Нефтепереработка обеспечивает выработку также и других важных продуктов, таких как моторное топливо (бензин, дизельное топливо и др.). Относительная ограниченность запасов нефти при высоких объемах ее добычи, ухудшении качества нефти вновь открываемых месторождений и, как следствие, значительный рост затрат на их разработку обусловливают изменение структуры и диверсификацию сырья для получения моторного топлива и продуктов органического синтеза. В этом отношении большую перспективу представляет уголь.
Уголь является наиболее распространенным углеродсодержащим полезным ископаемым. Интерес к нему как альтернативному нефти источнику сырья за последние годы возродился. Известны методы превращения угля в жидкие углеводороды и топливо. Наибольшее значение приобрели гидрогенизация угля и его газификация до СО и Н2 (производство синтез-газа) с последующим каталитическим синтезом углеводородов.
Существует два основных направления переработки синтез-газа. Первое – превращение синтез-газа в этилен и другие углеводороды, которые, в свою очередь, могут быть переработаны в промышленно важные химические продукты. Второе направление – прямое превращение синтез-газа или метанола, полученного из синтез-газа, в целевые продукты органического синтеза.
Моторное топливо и сырье для органического синтеза могут быть получены также из битуминозной нефти, сланцев и природного газа.
Поиск по сайту: