 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Порядок расчета
Согласно справочным данным, Δ Н 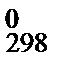 для данной реакции составляет +74 955 Дж.
для данной реакции составляет +74 955 Дж.
Уравнения молярных теплоемкостей имеют следующий вид:
С р(м) графит = 17,20 + 4,27 × 10-3 Т - 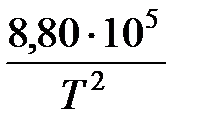 ;
;
С р(м) водород = 29,12 – 1,92 × 10-3 Т + 4,02 × 10-6 Т 2 - 0,88 × 10-9 Т 3;
С р(м) метан = 19,90 + 50,28 × 10-3 Т + 12,70 × 10-6 Т 2 - 11,02 × 10-9 Т 3.
Разности коэффициентов составят:
Δ а = 17,20 + 2 × 29,12 – 19,90 = 55,54;
Δ b = (4,27 – 2 × 1,92 – 50,28) × 10-3 = -42,17 × 10-3;
Δ с ' = -8,80 × 105;
Δ с = (2 × 4,02 – 12,70) × 10-6 = -4,66 × 10-6;
Δ d = [2 × (-0,88) + 11,02] × 10-9 = 9,26 × 10-9.
Найденные значения Δ а, Δ b, …, Δ d и Т = 298 К, а также стандартную энтальпию используем в уравнении (47), чтобы рассчитать постоянную интегрирования:
74 955 = I + 55,54 × 298 - 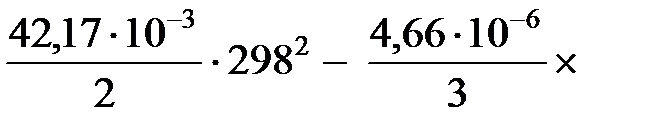

Постоянная интегрирования I = 13 776.
Искомое значение энтальпии реакции при температуре 1000 К находим по уравнению (47):
Δ Н 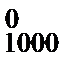 = 13 776 + 13,254 × 1000 -
= 13 776 + 13,254 × 1000 - 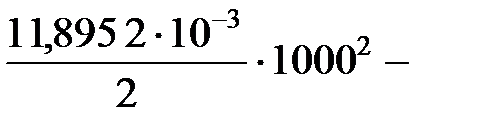
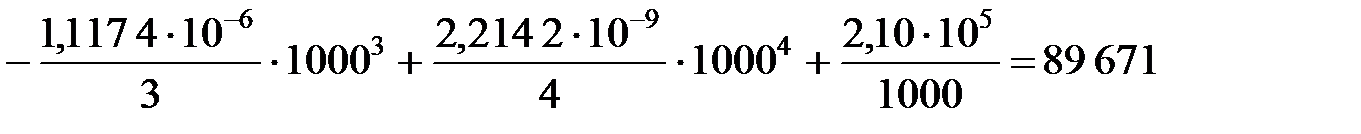 Дж.
Дж.
Количество выделившейся (или поглощенной) теплоты при протекании химической реакции зависит от степени превращения исходного реагента (х А) и значения теплового эффекта (изменения энтальпии):
Q х. р = Q х А n А,
где n А – химическое количество исходного реагента, моль (кмоль); Q – тепловой эффект реакции.
Исходя из вышеизложенного, уравнение теплового баланса будет иметь следующие составляющие:
Q исх = n А С р(м) А(Т А – Т 0),
Q х. р = QТ  x А n А,
x А n А,
или
Q х. р = QТx А n А, (48)
Q прод = n R С р(м)R(Т R – Т 0),
где n А, n R – химическое количество входящих реагентов и выходящих продуктов, моль или кмоль; Т А, Т R– температуры реагентов и продуктов соответственно, К; Т 0 – температура начала отcчета энтальпии, 298 К; Q 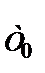 , QТ – тепловой эффект реакции при стандартной температуре и температуре в зоне реакции соответственно, кДж. Если размерность теплоемкости выражена в Дж/(кг × К) или кДж/(кг × К), то в уравнение вместо n подставляется m, т. е. масса реагентов или продуктов.
, QТ – тепловой эффект реакции при стандартной температуре и температуре в зоне реакции соответственно, кДж. Если размерность теплоемкости выражена в Дж/(кг × К) или кДж/(кг × К), то в уравнение вместо n подставляется m, т. е. масса реагентов или продуктов.
Необходимо отметить, что при составлении тепловых балансов могут вноситься следующие упрощения:
1) изменение Т мало отражается на величине Q. Это обусловлено возрастанием энтальпии всех реагентов с нагреванием. Допущение Q» const означает также малое влияние температуры на разность теплоемкостей исходной и прореагировавшей реакционных смесей;
2) средние значения Q и С р (удельной теплоемкости) в рабочем температурном интервале остаются практически неизменными.
Следовательно, теплоемкость всей смеси – произведение mС р – также мало различается для входного и выходного потоков. Если пользоваться массовыми величинами потоков, то и удельные теплоемкости можно принять мало меняющимися в процессе. Например, в синтезе аммиака, в котором С р компонентов (Н2, N2, NH3) различаются в несколько раз и в процессе значительно изменяется их содержание, теплоемкость смеси на входе отличается от теплоемкости смеси на выходе менее чем на 10%.
Исходя из вышеизложенного, уравнение теплового баланса (40), с учетом принятых допущений, можно записать в следующем виде:
m исх С рисх(Т 1 – Т 0) + Q х. р = m прод С р прод(Т 2 – Т 0),
m исх С рисх Т 1 – m исх С р исх Т 0 + Q х. р = m прод С р прод Т 2 – m прод С р прод Т 0.
Слагаемое m исх С р исхс учетом допущения (2) практически равно m прод С рпрод.Тогда после сокращения членов уравнения, содержащих Т 0, формула примет вид
m исх С р исх Т 1 + Q х. р = m прод С рпрод Т 2. (49)
Это уравнение можно использовать для расчета теплового баланса.
В технической литературе по расчетам химико-технологических процессов часто температурой начала отсчета энтальпии является 0ºС. В этом случае количество теплоты, поступающее в систему или выходящее из нее, рассчитывается по формуле
Q исх = n А С р Т А, Q прод = n R С р(м) Т R. (50)
Для оценки погрешности расчета теплового баланса с учетом уравнений (40) и (50) ниже рассмотрен следующий пример.
Пример 2. При производстве оксида этилена по реакции
С2Н4 + 0,5О2 = С2Н4О
при 280ºС и 1 атм этилен и кислород входят в реактор при 80ºС, причем кислород берут в 10%-ном избытке. Степень превращения С2Н4 равна 80%. Определить количество теплоты для поддержания изотермического процесса, если за час в реактор поступает 140 кг С2Н4.
D Н  ,
Дж/моль ,
Дж/моль
| С  80,
Дж/(моль × К) 80,
Дж/(моль × К)
| С 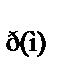 280,
Дж/(моль × К) 280,
Дж/(моль × К)
| n реаг, моль | n прод, моль | |
| С2Н4 | 52 417 | 46,8 | 58,5 | 1,0 – 0,8 = 0,2 | |
| О2 | 29,5 | 30,7 | 0,55 | 0,55 – 0,4 = 0,15 | |
| С2Н4О | -52 584 | - | 64,8 | 0,8 |
Порядок расчета
Произведем расчет теплового баланса для данного примера.
Используя следствие из закона Гесса, рассчитываем D Н 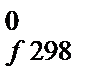 :
:
D Н 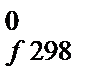 = -52 584 – 52 417 = -105 001 Дж.
= -52 584 – 52 417 = -105 001 Дж.
Другими словами на 1 моль подаваемого в реактор этилена будет выделяться 0,8 · 105 001 = 84 000 Дж тепла. Количество тепла, вносимое исходными веществами и выносимое продуктами, рассчитанное по формуле (40), равно
Q исх = 1 · 46,8 · (353 – 298) + 0,55 · 29,5 · (353 – 298) = 3465 Дж;
Q прод = 0,8 · 64, 8 · (553 – 298) + 0,55 · 29,5 · (553 – 298) =
= 17 384 Дж.
Таким образом, количество теплоты, которое необходимо отвести при подаче в реактор 1 моля этилена, составляет
Q отв = Q х.р + Q исх - Q прод = 84 000 + 3465 - 17 384 = 70 081 Дж.
С учетом того, что за час в реактор подается 140 кг этилена и степень его превращения составляет 0,8, количество теплоты, отводимое за час, составляет
Q отв = 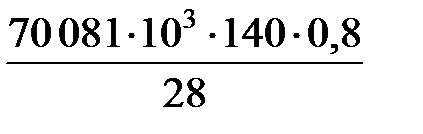 = 280 324 кДж.
= 280 324 кДж.
Рассчитаем тепловой баланс данного процесса с учетом температуры начала отсчета энтальпии, равной 0ºС (формула (50)):
Q вх = 1 · 46,8 · 80 + 0,55 · 29,5 · 80 = 5042 Дж.
Энтальпия продуктов составляет
Q вых = 0,8 · 64, 8 · 280 + 0,55 · 29,5 · 280 = 19 058 Дж;
Q отв = Q х.р + Q вх - Q вых = 84 000 + 5042 - 19 058 = 69 984 Дж.
Количество теплоты, отводимое за час, равно
Q отв = 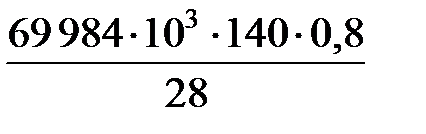 = 279 936 кДж.
= 279 936 кДж.
Таким образом, расхождение в результатах расчета составляет 0,14%.
Для фазовых превращений (испарение, конденсация, плавление, сублимация, растворение) количество выделяющегося (поглощенного) тепла рассчитывается следующим образом:
Q ф. пр =  , (51)
, (51)
где ni – химическое количество i -го компонента, изменившего свое фазовое состояние; q ф.пр – удельная теплота фазового превращения.
Тепловые потери вычисляются по известным формулам, в которые входит коэффициент теплопередачи, поверхность теплообмена и разность температур в реакционной и окружающей средах.
Подвод теплоты в аппарат Q п можно учитывать, исходя из потери количества теплоты теплоносителем, например греющей водой (m в С в):
 (52)
(52)
или по формуле теплопередачи через греющую стенку
Q п = k т F (T г – T x)t, (53)
где k т – коэффициент теплопередачи; F – поверхность теплообмена; T г, T x – средняя температура греющего агента (воды, пара и т. п.) и нагреваемого (холодного) вещества в аппарате соответственно; t – время.
По этой и другим формулам теплопередачи можно также определить отвод теплоты из зоны реакции или потерю теплоты в окружающую среду ( ).
).
Для паров значения энтальпии при различных температурах и давлениях приводятся в справочниках. Значение энтальпии перегретого пара при заданном давлении складывается из нескольких составляющих
I = с ж t кип + q исп + с п (t – t кип), (54)
где с ж – массовая теплоемкость жидкости, кДж/(кг ∙ К); t кип – температура кипения жидкости при данном давлении, ºС; q исп – теплота испарения жидкости при температуре t кип, кДж/кг; с п – теплоемкость перегретого пара, кДж/(кг ∙ К); t – температура пара, ºС.
Поэтому, если в тепловом балансе используется значение энтальпии пара, при расчете тепла смеси газов пар не учитывается.
Тепловые потери в аппарате Q п можно найти по формуле
Q п = K F ∆ t ср, (55)
где K – коэффициент теплопередачи, кДж/(м2 ∙ ч ∙ К); F – площадь теплопередачи, м2; ∆ t ср – средняя разность температур, ºС.
Расчеты по формуле (55) очень трудоемки. В то же время, учитывая, что аппараты обычно работают в стационарном режиме, т. е. потери тепла постоянны и известны, в условиях задач они приводятся в виде доли от прихода тепла.
Тепловой баланс в общем случае рассчитывают по данным материального баланса с учетом тепловых эффектов (экзотермических и эндотермических) химических реакций и физических превращений (испарение, конденсация и др.), происходящих в аппарате, с учетом подвода теплоты извне и отвода ее с продуктами реакции, а также через стенки аппарата.
Тепловой баланс, подобно материальному, выражают в виде таблиц и диаграмм, а для расчета используют следующее уравнение [9]:
Q т + Q ж + Q г + Q ф. пр + Q х.р + Q п = 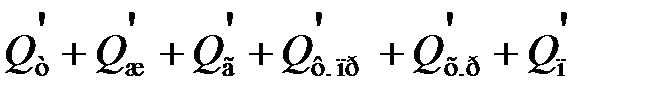 ,
,
где Q т, Q ж, Q г – количество теплоты, вносимое в аппарат твердыми, жидкими и газообразными веществами соответственно;  – количество теплоты, уносимое из аппарата выходящими целевыми и побочными продуктами реакции и непрореагировавшими исходными веществами в твердом, жидком и газообразном виде; Q ф. пр,
– количество теплоты, уносимое из аппарата выходящими целевыми и побочными продуктами реакции и непрореагировавшими исходными веществами в твердом, жидком и газообразном виде; Q ф. пр,  – теплота фазовых превращений, происходящих с выделением и поглощением теплоты соответственно; Q х.р,
– теплота фазовых превращений, происходящих с выделением и поглощением теплоты соответственно; Q х.р,  – количество теплоты в результате экзо- и эндотермических реакций; Q п – количество теплоты, подводимое в аппарат извне (топочными газами, нагретым воздухом, сжиганием топлива, электроэнергией и т. д.);
– количество теплоты в результате экзо- и эндотермических реакций; Q п – количество теплоты, подводимое в аппарат извне (топочными газами, нагретым воздухом, сжиганием топлива, электроэнергией и т. д.); 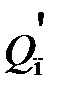 – потери теплоты в окружающую среду, а также отвод ее через холодильники, помещенные внутри аппарата.
– потери теплоты в окружающую среду, а также отвод ее через холодильники, помещенные внутри аппарата.
Теплоту, или тепловой поток (Вт), полученную при сжигании топлива или при превращении электрической энергии в тепловую за единицу времени (например, секунду), подсчитывают по следующей формуле:
 ,
,
где В – расход топлива, м3/с или кг/с; 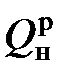 – низшая теплота сгорания топлива, Дж/м3 или Дж/кг.
– низшая теплота сгорания топлива, Дж/м3 или Дж/кг.
При подсчете количества теплоты сгорания топлива (кДж/кг) по его элементному составу в технических расчетах чаще всего используют формулу Менделеева:
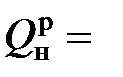 339,3С + 1256Н – 109(О – S) – 25,2(9H + W),
339,3С + 1256Н – 109(О – S) – 25,2(9H + W),
где С, Н, О, S – соответственно содержание углерода, водорода, кислорода и серы, мас. %; W – содержание влаги в рабочем топливе (с учетом содержания в нем золы, азота), мас. %.
Высшую теплоту сгорания  вычисляют при условии, что вся вода, образовавшаяся при сгорании, и влага, первоначально содержащаяся в топливе, конденсируются из отходящих газов в жидкость и охлаждаются до первоначальной температуры, т. е. до температуры, с которой поступает топливо в топку. Определяют
вычисляют при условии, что вся вода, образовавшаяся при сгорании, и влага, первоначально содержащаяся в топливе, конденсируются из отходящих газов в жидкость и охлаждаются до первоначальной температуры, т. е. до температуры, с которой поступает топливо в топку. Определяют  по формуле
по формуле
 + 25,2(9Н + W).
+ 25,2(9Н + W).
На основе элементного состава топлива теоретический расход воздуха m, кг/кг топлива, находят по уравнению
m теор = 0,116С + 0,348Н + 0,0435(S – О). (56)
Формула (56) получена из простого стехиометрического расчета, основанного на предположении, что весь углерод сгорает до СО2, водород – до Н2О, а сера – до SO2.
Часто рассчитывается теоретическая (адиабатическая) температура реакции горения. Она зависит от соотношения реагентов (например, избыточный воздух, вводимый в реактор, должен быть нагрет). Другие факторы, которые следует принимать во внимание, когда по расчету получается высокая теоретическая температура, – обратимость реакции и диссоциация продуктов. Так, при сгорании водорода в кислороде часть образующейся воды диссоциирует на водород и кислород и даже на Н+ и ОН-. В случае сгорания топлива в воздухе диссоциация продуктов при высоких температурах вследствие малых парциальных давлений может быть более интенсивной, чем это следует из данных, полученных для неразбавленных продуктов сгорания.
Теоретическую температуру реакции можно рассчитать из теплового баланса, когда известны зависимость мольной теплоемкости C р реагентов от температуры Т и тепловой эффект реакции Q х.р = -D Н  .
.
 (57)
(57)
Пример 3. Рассчитать теоретическую температуру реакции сгорания серы, если коэффициент избытка воздуха λ = 1,3. Принять приближенно, что Δ Н  ≈ Q р 273; используемый воздух подогрет до температуры Т" = 373 К.
≈ Q р 273; используемый воздух подогрет до температуры Т" = 373 К.
Sромб + О2 г = SO2 г; Δ Н  = -296,8 кДж.
= -296,8 кДж.
Поиск по сайту: