 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Энергетический баланс химико-технологических процессов
Эффективность использования энергии при осуществлении химико-технологического процесса устанавливается с помощью энергетического баланса. Основой его служит закон, математическая формулировка которого имеет вид [9]

где Е – энергия; m – масса; с – скорость света в вакууме.
Чаще для химико-технологических процессов ограничиваются составлением теплового баланса, отнеся его к тем единицам, которые использовались для составления материального баланса.
Если при проведении процесса энергия может подводиться или отводиться в иной форме, чем тепловая, то в общем балансе она учитывается с помощью соответствующих эквивалентов теплоты.
В таком балансе количества энергии, подведенные к системе и полученные в результате превращений (приход тепла), должны быть равны количествам, которые расходуются на проведение отдельных этапов процесса, преобразовываются в другие виды энергии и отводятся из системы материальными потоками, а также теряются в окружающую среду (расход тепла).
На практике часто составление теплового баланса осложнено неадиабатностью процесса, различием температур реагентов, нестехиометричностью, присутствием инертных газов и неполнотой протекания процесса. В связи с этим рассмотрим два примера.
Допустим, что Т исх ¹ Т прод (рис. 12). Тогда процесс можно представить происходящим в несколько стадий: реакция осуществляется при Т исх, а затем продукты нагреваются до Т прод (рис. 12, а) или вначале нагреваются исходные вещества, после чего проводят процесс (рис. 12, б). Возможен и такой вариант: охлаждают (нагревают) исходные вещества до некоторой температуры Т 0, проводят при ней реакцию, после чего продукты реакции нагревают (охлаждают) до Т прод (рис. 12, в). Хотя последний путь сложнее предыдущих, однако он предпочтительнее, если в качестве Т 0 выбрать 298,15 К. Вычисления упрощаются, если известны средние теплоемкости всех реагентов в рассчитываемом интервале температур.
Очевидно, что для схемы в можно записать следующее уравнение:
 (40)
(40)
Т прод
Т исх
Т 0
а б в
Рис. 12. Схема возможных путей протекания реального процесса:
а –; б –; в –
Здесь первое слагаемое представляет изменение энтальпии при переходе всех исходных веществ (включая и инертные газы, если они присутствуют в исходной смеси) от температуры Т исх входа их в реакционную зону до температуры Т 0 начала отсчета энтальпии; второе слагаемое равно тепловому эффекту реакции при Т 0 в расчете на 1 моль вещества (на которое ведется вычисление) и с учетом степени превращения х; третье слагаемое – это изменение энтальпии при нагревании всех веществ, покидающих зону реакции (продукты реакции, инертные вещества и непрореагировавшие исходные вещества). Если в процессе изменения температуры не происходит фазовых превращений, то все D Н пр будут равны нулю. Если же фазовые превращения имеют место, то для упрощения расчета их можно отнести к Т 0.
Для составления теплового баланса необходимо знать теплоемкости участвующих в процессе веществ, тепловые эффекты химических реакций (из термохимических расчетов) и теплоты фазовых преобразований.
В технологических расчетах используются значения молярной (С р(м)) или удельной (С р) теплоемкости. Молярные теплоемкости равны
 .
.
Удельные теплоемкости соответственно равны
 ,
,
где М – молярная масса, г/моль или кг/кмоль.
Когда n молей вещества обмениваются с окружающей средой Q кДж теплоты, и при этом температура вещества изменяется от Т 1 до Т 2, то средняя молярная теплоемкость при постоянном давлении (1) или объеме (2) равна
 . (41)
. (41)
Зависимость молярной теплоемкости от температуры выражается с помощью эмпирических уравнений
С р(м) = а + bT + cT 2 + dT 3,
C p(м) = a + bT +  , (42)
, (42)
где а, b, c, d – характерные для данного вещества постоянные (число членов зависит от требуемой степени точности и величины температурного интервала).
Для составления тепловых балансов процессов, для которых в широких пределах изменяется температура (например, процессов горения), нужно знать зависимость молярной теплоемкости веществ, участвующих в этом процессе, от температуры. Уравнения (42) дают возможность рассчитать истинные молярные теплоемкости при данной температуре. Если же вещество нагревается или охлаждается в широком интервале температур, то обычно в таких случаях определяется средняя молярная теплоемкость  для данного диапазона температур.
для данного диапазона температур.
Значения молярной теплоемкости некоторых газов приведены в табл. 10. Размерность теплоемкости в справочных таблицах может быть представлена в виде кал/(моль × град); Дж/(моль × К); кДж/(кмоль × К); кДж/(кг × К); кДж/(м3 × К). Размерность теплоемкости должна соответствовать размерности слагаемых членов уравнения теплового баланса.
Теплоемкость смеси – аддитивное свойство теплоемкостей составляющих ее компонентов С р(м):
 , (43)
, (43)
где Ni = ni /  .
.
Температура потоков в элементах ХТС изменяется за счет внутренних источников, одним из которых являются химические превращения.
Количество теплоты, которое выделяется или поглощается в результате реакции, вычисляется из термохимического уравнения
n а А + n b B + … = n r R + n s S + … + Q (-D Н), (44)
где Q – тепловой эффект реакции; D Н - энтальпия реакции.
Тепловой эффект Q и энтальпия D Н реакции противоположны по знаку (Q = -D Н).
Стандартные тепловые эффекты химических реакций могут быть рассчитаны на основе теплот образования веществ, участвующих в реакции, согласно следствию из закона Гесса. Теплоты образования веществ приведены в соответствующих справочниках. При этом в качестве стандартных условий приняты температура 298 К, давление 1 атм (101,325 кПа) и для растворенных веществ – концентрация 1 моль/кг растворителя. Газы и растворы предполагаются идеальными.
Значение теплового эффекта в уравнении (44) зависит от записи химического уравнения. Например, в уравнениях
N2 + 3H2 Û 2NH3 + Q
0,5N2 + 1,5H2 = NH3 + Q
значения Q различаются в 2 раза в соответствии со стехиометрическими коэффициентами. В справочной литературе тепловой эффект приводят для соответствующего уравнения либо при превращении 1 моля или 1 кмоля вещества.
Зависимость теплового эффекта реакции (изменения энтальпии) от температуры следует из закона Кирхгофа
 . (45)
. (45)
Из уравнения следует, что чувствительность D Н к изменению Т определяется абсолютным значением D С р(м), а знак температурного коэффициента теплового эффекта – знаком D С р(м). При D С р(м) > 0 тепловой эффект реакции растет с увеличением температуры, при D С р(м) < 0 – уменьшается, при D С р(м) = 0 – не зависит от температуры.
В соответствии с уравнением (42) уравнение (45) можно представить как
 , (46)
, (46)
где приращения Δ а,Δ в,Δ с,Δ d вычисляются как  и т. д.
и т. д.
После интегрирования уравнения (46) получим
 . (47)
. (47)
На основе значений стандартных теплот образования можно рассчитать энтальпию реакции D Н 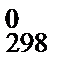 при температуре 298 К. Подставив в уравнение (47) значение D Н
при температуре 298 К. Подставив в уравнение (47) значение D Н 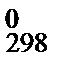 и температуру 298 К, найдем постоянную интегрирования I. Из уравнения (47) можно определить энтальпию реакции при любой температуре (в диапазоне, где действительно уравнение (42)).
и температуру 298 К, найдем постоянную интегрирования I. Из уравнения (47) можно определить энтальпию реакции при любой температуре (в диапазоне, где действительно уравнение (42)).
Пример 1. Рассчитать Δ Н 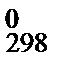 для реакции разложения метана при температуре Т = 1000 К:
для реакции разложения метана при температуре Т = 1000 К:
СН4 = С + 2Н2
Поиск по сайту: