 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Порядок расчета. Химическое количество образующегося метилового спирта составляет
Химическое количество образующегося метилового спирта составляет
 =
=  =
= 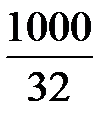 = 31,25 кмоль.
= 31,25 кмоль.
Так как 4% СН3ОН превращается в СН3ОСН3 по реакции (39), то масса образовавшегося СН3ОН равна
 =
= 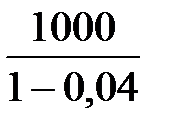 = 1041,667 кг.
= 1041,667 кг.
Следовательно, масса и химическое количество спирта, израсходованного при протекании реакции (39), составляет:
m = 1041,667 – 1000 = 41,7 кг;
n = 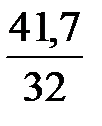 = 1,302 кмоль.
= 1,302 кмоль.
Химическое количество и масса образующихся продуктов по реакции (39) равны
 =
= 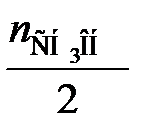 = 0,651 кмоль;
= 0,651 кмоль;
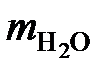 = 0,651 × 18 = 11,7 кг;
= 0,651 × 18 = 11,7 кг;
 кмоль;
кмоль;
 = 0,651 × 46 = 29,9 кг.
= 0,651 × 46 = 29,9 кг.
Согласно реакции (38), n СО =  .
.
С учетом того, что a = 0,93, находим
n СО = 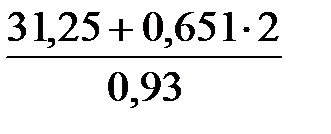 = 35,002 кмоль.
= 35,002 кмоль.
Значит, для получения 1000 кг СН3ОН необходимо подать:
V газа =  = 2450,2 м3;
= 2450,2 м3;
n газа = 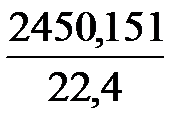 = 109,4 кмоль;
= 109,4 кмоль;
 = n газа × 0,66 = 109,382 × 0,66 = 72,192 кмоль;
= n газа × 0,66 = 109,382 × 0,66 = 72,192 кмоль;
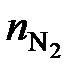 = 109,382 × 0,01 = 1,094 кмоль;
= 109,382 × 0,01 = 1,094 кмоль;
 =
= 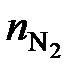 = 1,094 кмоль.
= 1,094 кмоль.
Рассчитаем массы газов:
 = 35,002 × 28 = 980,1 кг;
= 35,002 × 28 = 980,1 кг;
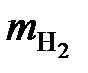 = 72,192 × 2 = 144,4 кг;
= 72,192 × 2 = 144,4 кг;
 = 1,094 × 28 = 30,6 кг;
= 1,094 × 28 = 30,6 кг;
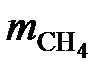 = 1,094 × 16 = 17,5 кг.
= 1,094 × 16 = 17,5 кг.
Определим содержание СО и Н2 в газах на выходе:
n СО = 35,002 - 31,25 - 2 × 0,651 = 2,45 кмоль;
 = 72,192 - 2 × (31,25 + 1,302) = 7,088 кмоль.
= 72,192 - 2 × (31,25 + 1,302) = 7,088 кмоль.
Вычислим массу СО и Н2.
m CO = 2,45 × 28 = 68,6 кг;
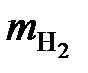 = 7,088 × 2 = 14,2 кг.
= 7,088 × 2 = 14,2 кг.
Результаты расчета материального баланса сводим в табл. 6.
Таблица 6
Материальный баланс производства СН3ОН
| Приход | Расход | ||||
| Статья | кмоль | кг | Статья | кмоль | кг |
| Газ | 109,4 | 1172,4 | СН3ОН | 31,3 | |
| В том числе | СО | 2,5 | 68,6 | ||
| СО | 35,0 | 980,1 | Н2 | 7,1 | 14,2 |
| Н2 | 72,2 | 144,2 | N2 | 1,1 | 30,6 |
| N2 | 1,1 | 30,6 | СН4 | 1,1 | 17,5 |
| СН4 | 1,1 | 17,5 | СН3ОСН3 | 0,7 | 29,9 |
| Н2О | 0,7 | 11,7 | |||
| Итого | 109,4 | 1172,4 | Итого | 44,9 | 1172,5 |
Пример 3. По приведенному в табл. 7 материальному балансу процесса получения сульфида натрия, в основе которого лежит следующая реакция:
Na2SО4 + 4Н2 = Na2S + 4Н2О
рассчитать: 1) теоретические и практические расходные коэффициенты; 2) степень превращения сульфата натрия и водорода; 3) состав готового безводного продукта; 4) интенсивность процесса (т/(ч × м3)), если объем реактора равен 10 м3. Молярная масса, г/моль или кг/кмоль: Na2S – 78; Na2SО4 – 142, Н2 – 2.
Таблица 7
Поиск по сайту: