 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Материальный баланс
Материальный баланс основан на законе сохранения массы вещества, согласно которому масса веществ, поступивших в замкнутую систему, равна массе веществ на выходе из нее. Применительно к материальному балансу любого технологического процесса это означает, что масса веществ, поступивших на технологическую операцию, – приход – равна массе всех веществ, получившихся в результате ее, – расходу.
Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку (Σ m прих), а правую – масса получаемых продуктов плюс производственные потери (Σ m ¢расх):
Σ m прих = Σ m ¢расх. (24)
Уравнение материального баланса может быть представлено в следующем виде:
m  + m
+ m  + m
+ m  + m
+ m  = m
= m 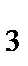 + m
+ m  + m
+ m  + m
+ m  (25)
(25)
где m  m
m  m
m  m 2 - массы поступившего газообразного, жидкого и твердого сырья и вспомогательного материала; m 3, m 4 - соответственно полученные целевой и побочный продукты; m 5 - непрореагировавшее сырье; m 6 – производственные потери.
m 2 - массы поступившего газообразного, жидкого и твердого сырья и вспомогательного материала; m 3, m 4 - соответственно полученные целевой и побочный продукты; m 5 - непрореагировавшее сырье; m 6 – производственные потери.
Слагаемые прихода и расхода, число которых зависит от состава производственных потоков, называют статьями материального баланса.
Материальный баланс – «зеркало» химико-технологического процесса, отражающее состав образующихся продуктов, природу исходных реагентов и вспомогательных материалов. На основании материального баланса можно рассчитать такие технологические показатели, как расходные коэффициенты сырья, вспомогательных материалов, выход целевых продуктов, побочных продуктов или отходов, степень использования сырья, селективность процесса.
Технологические показатели, получаемые на основе практического материального баланса, называют балансовыми характеристиками [8].
Расходные коэффициенты сырья (Рк1) и вспомогательных материалов (Рк2) вычисляются исходя из уравнения (25) следующим образом:
Рк1 = 
Рк2 = 
Выход целевого продукта (a1) и побочного продукта (a2) будет составлять
a1 = 
a2 = 
Степень превращения сырья х равна
х = 
Селективность процесса j вычисляют в тех случаях, когда в системе протекает несколько реакций, одна из которых целевая, а остальные - побочные. В этом случае по величине расхода сырья (m 1 - m 5) и по стехиометрическому уравнению целевой реакции рассчитывают стехиометрическое количество целевого продукта m  , после чего находят
, после чего находят
j = 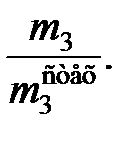
Кроме определения технологических показателей, материальный баланс позволяет установить, на каких этапах процесса следует искать другие решения, которые обеспечили бы большую эффективность использования сырья. Для этого, кроме баланса всего процесса, составляют балансы отдельных его этапов, единичных элементов или частичные балансы по компонентам.
Стехиометрический материальный баланс. Теоретический (стехиометрический) материальный баланс рассчитывают на основе стехиометрических коэффициентов в уравнениях реакции, предусматривающих полное превращение реагентов в продукты. Часто стехиометрический баланс составляется для реакции, выражающей полный ход процесса и являющейся суммой промежуточных этапов, т. е. для такой реакции, которой в действительности не существует. Удобнее всего составлять материальный баланс по отношению к 1 молю или 1 кмолю основного исходного вещества [7]. После этого по числу моль или кмоль находят объемы и массы исходных веществ и продуктов (кг, т, м3, л).
Стехиометрические коэффициенты в химических уравнениях показывают количество моль компонентов, вступивших в химическое взаимодействие. Их можно выразить в массовых величинах, умножая стехиометрические коэффициенты на молярную массу. Например, окисление диоксида серы описывается уравнением
SO2 + 0,5O2 ® SO3
Молярные массы составляют, г/моль или кг/кмоль: SO2 – 64; O2 – 32; SO3 – 80, и это же уравнение с «массовыми» стехиометрическими коэффициентами будет иметь следующий вид:
64SO2 + 16O2 ® 80SO3
В такой записи очевиден материальный баланс: суммарная масса исходных веществ равна массе продукта.
Пример 1. В производстве азотной кислоты определить количество HNO3, образующейся из 1 т аммиака.
Поиск по сайту: