 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глава 11. ФИЗИОЛОГИЯ И ПАТОЛОГИЯ ПЕРИОДА ПРЕ- И ПОСТМЕНОПАУЗЫ
Пре- и постменопауза соответствуют переходу от репродуктивного периода жизни женщины к пострепродуктивному с потерей детородной и угасанием гормональной функции организма (в прошлом переходный период назывался климактерическим от греч. climax - лестница, переход).
В переходном периоде выделяют:
• пременопаузу - период жизни женщины старше 45-47 лет, когда появляются климактерические симптомы (нейровегетативные, психоэмоциональные, обменно-эндокринные), до прекращения менструаций;
• менопаузу (производное от греч. menos - месяц и pauses -окончание) - последняя самостоятельная менструация;
• постменопаузу - отсутствие менструаций в течение 12 мес и более. Выделяют раннюю постменопаузу (первые 2 года) и позднюю (продолжительность более 2 лет);
• перименопаузу, включающую пременопаузу и 2 года после менопаузы. Дату последней менструации можно установить только ретроспективно,
длительность названных выше периодов определяют, изучая анамнез.
В переходном периоде жизни женщины наибольшие изменения претерпевает гипоталамо-гипофизарно-яичниковая система: повышается порог чувствительности гипоталамуса к эстрогенам, утрачивается цирхоральный ритм выделения ГнРГ, увеличивается выработка ФСГ и ЛГ (соответственно в 14 и 3 раза), уменьшается синтез ингибина, формируется резистентность фолликулов к гонадотропинам. В пременопаузе постепенно возникает недостаточность желтого тела, прогрессирующе нарастает число ановуляторных циклов, истощаются фолликулярные резервы. Прекращение циклической функции яичников совпадает с менопаузой. У женщин в постменопаузе не вырабатывается прогестерон и снижается секреция эстрогенов, меняется их соотношение, основным становится наименее активный эстроген - эстрон. Концентрация эстрона в плазме крови женщин в постменопаузе в 3-4 раза больше, чем эстрадиола. Эстрон в постменопаузе образуется в жировой и мышечной ткани из андростендиона, который в большей степени секре-тируется надпочечниками и в меньшей - яичниками.
Указанные нейроэндокринные изменения приводят к инволюционным процессам в органах репродукции. В пременопаузе существенных изменений размеров и структуры матки и яичников по сравнению с таковыми у женщин репродуктивного возраста не происходит.
Матка, являясь органом-мишенью для стероидных половых гормонов, после менопаузы теряет в среднем 1/3 своего объема в результате атрофиче-ских процессов в миометрии, которые максимально интенсивны в первые 2-5 лет после менопаузы, после 20 лет постменопаузы размеры матки не изменяются.
При небольшой длительности постменопаузы миометрий имеет среднюю эхогенность, возрастающую с увеличением продолжительности постменопаузы. Появляются множественные гиперэхогенные участки, соответствующие фиброзу миометрия. Кровоток в матке, по данным допплеровского исследования, становится скудным и регистрируется лишь в периферических слоях миометрия.
Эндометрий после менопаузы перестает претерпевать циклические изменения и подвергается атрофии. Продольный и поперечный размеры полости матки уменьшаются. При УЗИ переднезадний размер М-эха уменьшен до 4-5 мм и менее, эхогенность повышена (рис. 11.1). Выраженная атрофия эндометрия при длительной постменопаузе может сопровождаться формированием синехий, визуализируемых как небольшие линейные включения повышенной эхо-плотности в структуре М-эха. Скопление небольшого количества жидкости в полости матки, визуализируемое при сагиттальном сканировании в виде анэхогенной полоски на фоне атрофичного тонкого эндометрия, не является признаком патологии эндометрия и возникает в результате сужения (заращения) цервикального канала, препятствующего оттоку содержимого полости матки.
В постменопаузе уменьшаются линейные размеры и объем яичника, меняется его эхоструктура. Выделяют атрофический и гиперпластический типы яичника в постменопаузе.
У яичника атрофического типа значительно уменьшены размеры и объем, снижена звукопроводимость, имеются гиперэхогенные участки, соответствующие преобладающему соединительнотканному компоненту. При
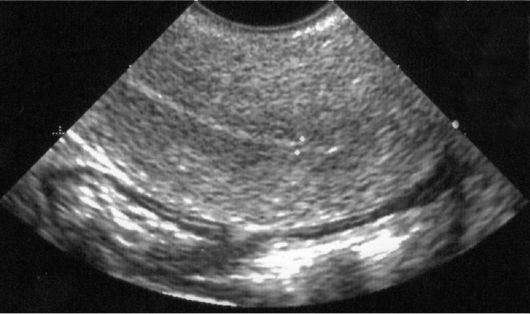
Рис. 11.1. М-эхо в постменопаузе. УЗИ
допплеровском исследовании цветовые эхо-сигналы кровотока в структуре яичника отсутствуют.
При яичнике гиперпластического типа линейные размеры уменьшаются медленно, звукопроводимость яичниковой ткани средняя, что соответствует гиперплазии текаклеток. Возможны мелкие жидкостные включения, которые при ранней постменопаузе соответствуют сохраненным фолликулам, при длительной постменопаузе - инклюзионным кистам. Единичные цветовые эхо-сигналы кровотока регистрируются в центральной части гиперпластического яичника. Считается, что при гиперпластическом типе яичника в большей мере, чем при атрофическом, сохранена андрогенная гормонопродукция в постменопаузе.
Дефицит эстрогенов как часть инволюционных процессов в организме женщины в пре- и постменопаузе можно расценивать как закономерный физиологический процесс, хотя он играет патогенетическую роль для многих расстройств, в том числе климактерических. Нейровегетативные, обменно-эндокринные, психоэмоциональные проявления (ранние), уроге-нитальные расстройства, атрофические изменения кожи, слизистых оболочек (средневременные), остеопороз, сердечно-сосудистые заболевания (поздние) возникают в определенной хронологической последовательности и значительно снижают качество жизни женщины в постменопаузе. Различные симптомы, связанные с угасанием функции яичников, наблюдаются более чем у 70% женщин.
Частота проявлений климактерического синдрома меняется с возрастом и длительностью постменопаузы. Если в пременопаузе она составляет 20- 30%, то в постменопаузе - 35-50%. Продолжительность климактерического синдрома составляет в среднем 3-5 лет (от 1 года до 10-15 лет). Самыми частыми его проявлениями служат приливы, потливость, повышение или понижение АД, головная боль, нарушения сна, депрессия и раздражительность, астенические проявления, симпатико-адреналовые кризы. Оценку тяжести климактерического синдрома производят с помощью индекса Куп-пермана. В 40% наблюдений климактерический синдром имеет легкое течение, в 35% - среднетяжелое, в 25% - тяжелое.
Урогенитальные расстройства могут возникать еще в пременопаузе, но обычно появляются на 2-5-м году постменопаузы у 30-40% женщин. В пожилом возрасте их частота может достигать 70%. Возникновение урогени-тальных расстройств обусловлено развитием на фоне дефицита половых гормонов атрофических и дистрофических процессов в эстрогенчувствительных структурах мочеполовой системы (уретра, мочевой пузырь, влагалище, связочный аппарат, мышечный и соединительнотканный компоненты тазового дна, сосудистые сплетения). Этим объясняется одновременное нарастание клинических симптомов атрофического вагинита, диспареунии, цистоуретри-та, поллакиурии, недержания мочи. В постменопаузе нередко прогрессирует пролапс половых органов, в основе которого лежат нарушения биосинтеза и депонирования коллагена в фибробластах на фоне гипоэстрогении, поскольку на фибробластах имеются рецепторы эстрогенов и андрогенов.
Одним из последствий эстрогендефицитного состояния в пре- и постменопаузе становится увеличение частоты сердечно-сосудистой патологии,
обусловленной атеросклерозом (ИБС, нарушение мозгового кровообращения, АГ). Для женщин в постменопаузе это катастрофично: если у женщин до 40 лет частота инфаркта миокарда в 10-20 раз ниже, чем у мужчин, то после угасания функции яичников соотношение постепенно меняется и составляет к 70 годам 1:1. Возникновение сердечно-сосудистой патологии патогенетически связано с изменением содержания липидов и свертывающей системы крови при гипоэстрогении: повышением уровня холестерина, триглицеридов, липопротеидов низкой и очень низкой плотности, снижением уровня липопротеидов высокой плотности, увеличением свертываемости крови и снижением антикоагулянтного потенциала системы гемостаза. Считают, что длительный дефицит эстрогенов в пожилом возрасте может участвовать в патогенезе болезни Альцгеймера (поражение головного мозга). Отмечен профилактический эффект эстрогенов в отношении деменции у женщин в постменопаузе, но этот вопрос требует дальнейших исследований в рамках доказательной медицины.
Эстрогендефицитное состояние после менопаузы приводит к остео-порозу у 40% пациенток. Остеопороз и предшествующая ему остеопения имеют длительный латентный период. Снижение синтеза матрикса кости остеобластами и усиление процессов резорбции костной ткани остеокластами начинаются уже после 35-40 лет. Потеря костной массы после прекращения менструаций резко ускоряется и достигает 1,1-3,5% в год. К 75-80 годам потеря костной плотности может приблизиться к 40% по сравнению с таковой в возрасте 30-40 лет. У 35,4% женщин, доживших до 65 лет, можно прогнозировать переломы костей. Остеопороз развивается постепенно и бессимптомно, а возникновение его клинических проявлений свидетельствует о значительной потере костной массы. Это - боли в костях, микро- и макропереломы при минимальной травматизации, искривление позвоночника (кифоз, лордоз, сколиоз), уменьшение роста. Поскольку в первые 5 лет после прекращения менструаций поражаются преимущественно кости с преобладанием трабекулярного, решетчатого строения (позже присоединяется поражение трубчатых костей), переломы позвоночника, лучевой кости в типичном месте возникают раньше, чем перелом шейки бедра. Рентгенологическое исследование не обеспечивает своевременную диагностику остеопороза (она становится возможной, только когда потеря костной массы достигает 30% и более). Диагностика остеопороза, помимо клинических проявлений, основывается на денсито-метрии.
Факторы риска остеопороза:
- возраст (риск увеличивается с возрастом) - постменопауза;
- пол (у женщин риск выше, чем у мужчин; женщины составляют 80% всех больных остеопорозом);
- раннее наступление менопаузы, особенно до 45 лет;
- расовая принадлежность (наибольший риск у женщин европеоидной расы);
- субтильное телосложение, небольшая масса тела;
- недостаточное потребление кальция;
- малоподвижный образ жизни;
- курение, алкогольная зависимость;
- семейная отягощенность по остеопорозу; полиморфизм гена, отвечающего за синтез рецептора витамина D;
- аменорея в репродуктивном возрасте;
- 3 родов и более в анамнезе, длительная лактация. Единственным патогенетически обоснованным и эффективным методом
коррекции климактерических расстройств является ЗГТ, для чего используют натуральные эстрогены (эстрадиола валерат, 17-β-эстрадиол, конъюгиро-ванные эстрогены, эстриол) в комбинации с гестагенами или андрогенами. Возможны введение гормонов парентерально (в инъекциях, трансдермаль-но, вагинально) и прием внутрь.
Для коррекции климактерического синдрома, урогенитальных расстройств используют краткосрочные курсы ЗГТ (в течение 1-3 лет). С целью профилактики и лечения остеопороза ЗГТ проводится на протяжении более 3 лет при необходимости в комбинации с бифосфонатами.
В пременопаузе целесообразно назначать эстроген-гестагенные препараты (дивина♠, климен♠, климонорм♠, фемостон♠, цикло-прогинова♠, три-секвенс♠), в постменопаузе более физиологично постоянное поступление гормонов (прогинова♠-21, эстрадиол, гинодиан депо♠, клиогест♠, тиболон - ливиал♠).
ЗГТ, начатая в позднем периоде жизни женщины, может повышать риск рака молочной железы, частоту сердечно-сосудистых заболеваний: тромбозов, тромбоэмболии, инфарктов, инсультов.
Перед назначением ЗГТ важно изучить особенности анамнеза: наследственность, наличие вредных привычек (курение), состояние венозной системы ног. До начала и в процессе ЗГТ необходимо проводить физикаль-ный осмотр, эхографию органов малого таза, маммографию, исследование показателей гемостаза.
Принципы назначения ЗГТ основаны на индивидуальной оценке ее пользы и риска, информировании пациентки о преимуществах и возможных осложнениях терапии. Осознанное решение о применении гормонов с заместительной целью принимает сама пациентка.
Гормональные и нейрообменные изменения, процессы инволюции в организме женщины в условиях нестабильности системы гомеостаза в переходном периоде способствуют развитию такой патологии, как миома матки, аденомиоз, опухоли яичников, гиперпластические процессы эндометрия, дисфункциональные маточные кровотечения (см. соответствующие разделы). В постменопаузе перечисленные заболевания органов-мишеней половых гормонов (кроме опухолей яичников) подвергаются обратному развитию, вместе с тем на этот период приходится пик заболеваемости злокачественными опухолями половых органов (средний возраст больных раком эндометрия - 62 года, раком яичников - 60 лет, раком шейки матки - 51 год), поэтому у пациенток в постменопаузе нужна особенная онкологическая настороженность.
В постменопаузе узлы миомы, возникшие еще в пременопаузе, как и матка, подвергаются инволюции - уменьшается их диаметр, причем узлы с исходно повышенной эхоплотностью (фиброма) претерпевают наимень-
шие изменения, а узлы средней или пониженной эхогенности (лейомиома) уменьшаются наиболее заметно. Наряду с этим повышается эхоплотность, особенно капсулы миоматозных узлов, что может приводить к ослаблению эхо-сигнала и затруднять визуализацию внутренней структуры узлов миомы и матки. Редко встречается кистозная дегенерация узла миомы (субсерозной локализации) с множеством полостей и гипоэхогенным содержимым. При исследовании кровотока в миоматозных узлах, подвергшихся атрофии, интранодулярная регистрация цветовых эхо-сигналов нехарактерна, пери-нодулярный кровоток скудный. При интерстициальных узлах атрофические процессы в матке в постменопаузе могут приводить к усилению центрипе-тальных тенденций и появлению субмукозного компонента миоматозного узла. Субмукозное расположение миоматозных узлов в постменопаузе может приводить к кровотечению. Эхография при этом не позволяет адекватно оценить М-эхо, которое трудно дифференцировать с капсулой узла миомы и определить причину кровотечения (субмукозный узел, сопутствующая патология эндометрия?). Разрешить диагностические трудности позволяют ГСГ (рис. 11.2) и гистероскопия. Инволютивные процессы в матке и узлах миомы отражают преобладание апоптоза.
Увеличение матки и (или) миоматозных узлов в постменопаузе, если оно не стимулировано ЗГТ, всегда требует исключения гормонпродуцирующей патологии яичников или саркомы матки.
Гиперпластические процессы эндометрия возникают на фоне повышенной концентрации эстрогенов (классических и неклассических стероидов), реализующих пролиферативный эффект, воздействуя на рецепторы эстрогенов в ткани эндометрия. Частота выявления рецепторов эстрогенов и прогестерона, а также их концентрация варьируют в зависимости от вида патологии эндометрия и уменьшаются по мере прогрессирования пролиферативных процессов эндометрия: железистые полипы эндометрия - железисто-фиброзные полипы - железистая гиперплазия - атипи-

Рис. 11.2. Гидросонография
ческие гиперплазия и полипы эндометрия - рак. Гиперэстрогенемия в пре-и постменопаузе может быть обусловлена:
• ановуляцией и недостаточностью лютеиновой фазы (в пременопаузе);
• избыточной периферической конверсией андрогенов в эстрогены при ожирении, особенно висцеральном;
• гормонпродуцирующими структурами в яичнике (текоматоз, опухоли);
• патологией печени с нарушением инактивационной и белково-синтетической (снижение синтеза белков - носителей стероидных гормонов) функций;
• патологией надпочечников;
• гиперинсулинемией (при сахарном диабете), приводящей к гиперплазии и стимуляции стромы яичника.
В постменопаузе как доброкачественные, так и злокачественные гиперпластические процессы эндометрия могут клинически проявляться кровяными выделениями из половых путей, но нередко остаются бессимптомными. Женщины в постменопаузе 2 раза в год должны проходить скрининговое обследование с УЗИ, а при необходимости (в группах риска по раку эндометрия) - с аспирационной биопсией эндометрия. При эхографиче-ском скрининге патология эндометрия в постменопаузе выявляется у 4,9% женщин при отсутствии жалоб. При ультразвуковых признаках патологии эндометрия выполняют гистероскопию и раздельное диагностическое выскабливание слизистой оболочки матки с последующим гистологическим исследованием соскобов. Осмотр полости матки при гистероскопии всегда позволяет выявить изменения эндометрия и проконтролировать удаление патологического очага.
Эхографические признаки полипов эндометрия (как в пре-, так и в постменопаузе): локальное утолщение М-эха, включения повышенной эхо-генности в его структуре, иногда с визуализацией цветовых эхо-сигналов кровотока в проекции включения. Диагностические трудности возможны при железистых полипах эндометрия, звукопроводимость с которых близка к таковой оболочки матки. Гиперплазия эндометрия в постменопаузе вызывает утолщение М-эха более 4-5 мм с сохранением четких контуров, частыми мелкими жидкостными включениями в структуре М-эха (рис. 11.3). При раке эндометрия эхографическая картина полиморфна.
По данным морфологического исследования выделяют доброкачественные (фиброзные, железисто-фиброзные, железистые полипы, железистая гиперплазия), предраковые пролиферативные процессы эндометрия (атипическая гиперплазия и полипы эндометрия с атипией клеток), рак эндометрия. Однако прогноз при гиперпластических процессах коррелирует не только с видом патологии эндометрия, но и с пролиферативным потенциалом ткани эндометрия. Высоковероятны рецидив, прогрессирование и малигнизация при атипических формах гиперплазии и полипах эндометрия с высокой пролиферативной активностью клеток.
Причиной рецидивов пролиферативных процессов эндометрия являются как опухолевые, так и неопухолевые (текоматоз) гормонпродуцирующие структуры яичников, сохраняющиеся нейрообменные нарушения.

Рис. 11.3. Гиперплазия эндометрия
При скрининговом обследовании женщин при отсутствии жалоб частота патологии яичников, выявляемой при эхографии, составляет 3,2%. Среди всех опухолей женской половой сферы опухоли яичника занимают 2-е место, при этом доля доброкачественных опухолей составляет 70-80%, злокачественных - 20-30%. Средний возраст больных раком яичников - 60 лет.
В 70% случаев заболевание протекает бессимптомно и лишь у 30% больных выявляется скудная и непатогномоничная симптоматика. Даже при осложненном течении заболевания (разрыв опухоли, перекрут ножки) болевые ощущения у пожилых больных, как правило, не выражены. Диагностика патологии яичника в постменопаузе затруднена в связи с частым ожирением, опущением внутренних половых органов, атонией кишечника, спаечным процессом.
Контрольные вопросы
1. Дайте понятие менопаузы, определение периода постменопаузы.
2. Укажите характерные гормональные изменения у женщины после наступления менопаузы.
3. Что относят к климактерическим расстройствам?
4. Перечислите принципы коррекции климактерических расстройств в постменопаузе.
Поиск по сайту: