 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІІІ.3. Нерівноважні явища в електролітах. Електропровідність розчинів електролітів
В розчині електроліту сольватовані іони знаходяться в хаотичному тепловому русі. При накладанні електричного поля виникає дещо упорядкований рух іонів (міграція) до протилежно заряджених електродів. Іони рухаються під дією сили, що надає їм прискорення, проте одночасно із зростанням швидкості їх рух уповільнюється опором середовища. А тому через малий проміжок часу швидкість руху іонів стає постійною.
Для іонів і-того виду швидкість руху в електричному полі визначається силою, що діє на іон, яка рівна добутку заряду іона на градієнт потенціалу поля, і фактором R, що характеризує опір середовища, який залежить від температури, природи іона і розчинника:
 , (ХІІІ.3.1)
, (ХІІІ.3.1)
де е – елементарний електричний заряд; zi – кількість елементарних електричних зарядів, що несе один іон (зарядність іона);Е – різниця потенціалів між електродами; l – віддаль між електродами.
Порівняння швидкостей різних видів іонів здійснюється при градієнті потенціалу поля, рівному 1 В/м. В цих умовах швидкість руху іонів називають абсолютною швидкістю або електричною рухливістю іонів (розмірність м2/Вс):
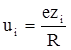 (ХІІІ.3.2)
(ХІІІ.3.2)
Кожний вид іонів переносить певну кількість електрики, яка залежить від заряду, концентрації іонів і швидкості їх руху в електричному полі. Для оцінки частки електрики, що переноситься даним видом іонів введено поняття про числа перенесення.
Число перенесення іонів і-того виду – це відношення кількості електрики qi , що переноситься даним видом іонів, до загальної кількості електрики q,що переноситься всіма іонами, які знаходяться в розчині:
 (ХІІІ.3.3)
(ХІІІ.3.3)
У відповідності до цього визначення сума чисел перенесення всіх видів іонів в розчині рівна одиниці.
Для бінарного електроліту КА, що дисоціює на два види іонів Кz+ і Аz-, кількість електрики, що переноситься катіонами і аніонами за секунду:
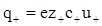 ;
;  (ХІІІ.3.4)
(ХІІІ.3.4)
де z+, z- - заряд катіона і аніона; с+, с- - їх концентрація; u+, u- - електричні рухливості іонів.
Згідно рівняння число перенесення катіонів
 (ХІІІ.3.5)
(ХІІІ.3.5)
Так як розчини електронейтральні, то z+c+=z-c- і рівняння (ХІІІ.3.5) приймає вигляд
 (ХІІІ.3.6)
(ХІІІ.3.6)
Число перенесення аніонів
 (ХІІІ.3.7)
(ХІІІ.3.7)
У водному розчині електроліту відбувається гідратація іонів (в загальному випадку сольватація), що приводить до утворення досить стійких міцних сполук між іонами і молекулами розчинника. Розміри частинок, що утворюються, визначаються розмірами іонів і ступінню їх гідратації. При накладанні на розчин електричного поля іони мігрують разом з гідратними оболонками. Рух гідратованого іону уподібнимо руху мікроскопічної кульки у в’язкому середовищі і тоді його електричну рухливість ui можна якісно оцінити формулою Стокса:
 , (ХІІІ.3.8)
, (ХІІІ.3.8)
де F – сила, що діє на іон; η – коефіцієнт в’язкості середовища; rі – ефективний радіус частини.
У відповідності з (ХІІІ.3.8) іони з високою ступінню гідратації володіють меншою електричною рухливістю, ніж слабко гідратовані іони.
Із рівнянь (ХІІІ.3.6) і (ХІІІ.3.7) видно, що число перенесення даного виду іонів залежить від електричної рухливості обох видів іонів, на величини їх електричної рухливості і числа перенесення чинять вплив концентрація розчину і температура. Для більшості електролітів із зростанням концентрацій приблизно до 0,1 моль/л числа перенесення іонів змінюються незначно. Для більш високих концентрацій ці зміни більш помітні. Підвищення температури супроводжується дегідратацією іонів, причому розміри гідратних оболонок дуже гідратованих іонів зменшуються більш різко, ніж слабко гідратованих. Таким чином, величини рухливості катіонів і аніонів зближуються і t+ і t- прямують до 0,5.
При протіканні електричного струму через електрохімічну систему відбувається зміна вмісту електроліту в розчині біля електродів. Це пов’язано з тим, чи беруть участь іони, що проводять електричний струм в електродному процесі чи ні. В залежності від цього концентрація іонів в приелектродному шарі буде або зменшуватись, або зростати.
Розрізняють дві основні групи провідників електричного струму: провідники першого роду, електрична провідність яких обумовлена електронами, і провідники другого роду, що володіють іонною провідністю. Головну роль в електрохімії відіграють провідники другого роду – розчини і розплави електролітів. Мірою здатності речовин проводити електричний струм є електрична провідність L – величина, що обернена до електричного опору R. Так як
 (ХІІІ.3.9)
(ХІІІ.3.9)
то
 , (ХІІІ.3.10)
, (ХІІІ.3.10)
де ρ – питомий опір, Ом·м; S – поперечний переріз, м2; l – довжина провідника, м; c – питома електропровідність.
Питома електропровідність розчину електроліту – це електрична провідність об’єму розчину, що знаходиться між двома паралельними електродами, які мають площу по 1м2 і розташовані на віддалі 1м один від одного.
На підставі рівнянь (ХІІІ.3.9) і (ХІІІ.3.10) запишемо рівняння для визначення питомої електропровідності:
 (ХІІІ.3.11)
(ХІІІ.3.11)
Обернена величина до одиниці опору є Сіменс (См).
Величина питомої електропровідності прямо пропорційно залежить від числа іонів в одиниці об’єму (концентрації), швидкості їх переміщення і заряду, що переноситься кожним іоном.
Ця залежність виражається рівнянням
 (ХІІІ.3.12)
(ХІІІ.3.12)
де α – ступінь дисоціації; с – концентрація (кмоль-екв/м3);U+ i U- - абсолютні швидкості руху катіона і аніона (м2/с·В), тобто шлях в метрах, що проходять іони за 1с при градієнті потенціалу в 1В/м.
 Залежність питомої електропровідності електролітів від концентрації подана на рис. 73.
Залежність питомої електропровідності електролітів від концентрації подана на рис. 73.
В розбавлених розчинах сильних і слабких електролітів ріст електропровідності з підвищенням концентрації обумовлений збільшенням числа іонів, що переносять електрику. В області концентрованих розчинів підвищення концентрації супроводжується збільшенням в’язкості розчину та зростанням міжіонної взаємодії, що знижує швидкість руху іонів і електропровідність.
Окрім цього, у слабких електролітів в концентрованих розчинах помітно знижується ступінь дисоціації.
Виявити які-небудь прості загальні закономірності в залежності питомої електропровідності від концентрації розчину не вдалося. Значно більших результатів в цьому відношенні вдалося досягти користуючись величиною молярної електропровідності. Молярна електрична провідність розчину – міра електричної провідності всіх іонів, що утворюються при дисоціації 1 моль електроліту за даної концентрації. Вона чисельно рівна електричній провідності об’єму V (м3) розчину, що міститься між двома паралельними електродами, які знаходяться на віддалі 1 м, причому кожний електрод має таку площу, щоб в цьому об’ємі містився 1 моль розчиненої речовини. Між молярною і питомою електричними провідностями є співвідношення
 , (ХІІІ.3.13)
, (ХІІІ.3.13)
де λ – молярна електрична провідність, См/моль (Ом-1м2/моль); V – розведення розчину, м3/моль; с – концентрація, моль/м3.
Якщо концентрація розчину виражена в моль/л, то рівняння  (ХІІІ.3.13) записується у вигляді
(ХІІІ.3.13) записується у вигляді
 (ХІІІ.3.14)
(ХІІІ.3.14)
З рівнянь (ХІІІ.3.12) і (ХІІІ.3.13) випливає

 (ХІІІ.3.15)
(ХІІІ.3.15)
Загальний характер змін молярної електричної провідності при зміні концентрації для сильних і слабких електролітів передається кривими, що подані на рис. 74. Із збільшенням розведення молярна електрична провідність зростає і в області великих розведень прямує до граничного значення l¥. Ця величина відповідає електропровідності гіпотетичного нескінченно розведеного розчину, що характеризується повною дисоціацією електроліту (l=1) і відсутністю сил електростатичної взаємодії між іонами. У відповідності до (ХІІІ.3.15) молярна електропровідність безмежно розбавленого розчину може бути виражена рівнянням:
 (ХІІІ.3.16)
(ХІІІ.3.16)
Добуток zFui,¥=li,¥ називається граничною молярною електричною провідністю (рухливістю) іона. Тому рівняння (ХІІІ.3.16) можна записати так
 (ХІІІ.3.17)
(ХІІІ.3.17)
Для бінарного електроліту, коли z=1 матимемо

 (ХІІІ.3.18)
(ХІІІ.3.18)
Таким чином, величина молярної електропровідності безмежно розбавленого розчину електроліту є сумою двох незалежних складових, кожна з яких відповідає певному виду іонів. Це співвідношення встановлене Кольраушем і називається законом незалежного руху іонів. Гранична молярна електропровідність є специфічною величиною для даного виду іонів і залежить лише від природи розчинника і температури. З рівнянь (ХІІІ.3.15) і (ХІІІ.3.16) випливає
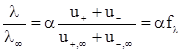 , (ХІІІ.3.19)
, (ХІІІ.3.19)
де 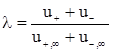 - коефіцієнт електропровідності.
- коефіцієнт електропровідності.
Електричні рухливості в розбавлених розчинах слабких і в безмежно розбавлених сильних електролітів близькі між собою (fl=1),тому для них
 (ХІІІ.3.20)
(ХІІІ.3.20)
Зростання молярної електропровідності із збільшенням розведення (рис. 74) для слабких електролітів може бути пояснене на основі уявлень класичної теорії електролітичної дисоціації, згідно з якою із збільшенням розведення ступінь дисоціації електроліту зростає і прямує до 1. Для сильних електролітів, що дисоціюють повністю,
 (ХІІІ.3.21)
(ХІІІ.3.21)
Характер електричної провідності розбавлених розчинів сильних електролітів був пояснений Онзагером з допомогою електростатичної теорії Дебая і Гюккеля. Він вважав, що взаємодія іонів викликає появу двох видів гальмування. Електрофоретичне гальмування пов’язане з тим, що центральний іон і його іонна атмосфера рухаються в електричному полі назустріч один одному, що рівносильно руху іона в зустрічному русі рідини. При цьому виникає більше тертя, ніж при русі в нерухомій рідині, а електрична провідність зменшується на величину Dl1.
Переміщення центрального іона під дією електричного поля виводить його з центру попередньої іонної атмосфери, яка потім руйнується за рахунок теплового руху іонів, а навколо наступного положення центрального іона утворюється нова іонна атмосфера. Утворення і руйнування іонної атмосфери відбувається з великою, проте кінцевою швидкістю, а тому заряд іонної атмосфери попереду іона, що рухається, завжди менший, ніж позаду нього. Така несиметричність іонної атмосфери веде до виникнення релаксаційного гальмування і до зменшення електричної провідності на величину Dl2.
Таким чином, електрична провідність розчину електроліту повинна бути меншою її граничного значення, яка могла б спостерігатись лише при безмежному розведенні розчину, коли сила взаємодії іонів перетворюється в нуль:
 (ХІІІ.3.22)
(ХІІІ.3.22)
Онгазер розрахував величини Dl1 і Dl2 і одержав рівняння бінарного електроліту з однозарядними іонами
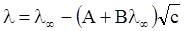 , (ХІІІ.3.23)
, (ХІІІ.3.23)
де А і В – константи, що залежать від природи розчинника і температури.
Експериментально встановлено, що електрична провідність сильного електроліту значно збільшується в сильних електричних полях (ефект Віна) і в полях високої частоти(ефект Дебая-Фанкельгагена).
В дуже сильному електричному полі швидкість руху іонів електроліту може бути настільки велика, що іонна атмосфера не встигає сформуватися. В наслідок чого як електрофоретичне, так і релаксаційне гальмування зникає, а електрична провідність приймає граничне значення.
В полі високої частоти іонна атмосфера зберігається, але всі іони здійснюють зворотно – поступальний рух настільки малої амплітуди, що симетричне розташування іонної атмосфери практично не порушується, а релаксаційне гальмування зникає.
В неводних розчинах з низькою діелектричною проникливістю розчинника спостерігається поява максимумів і мінімумів молярної електричної провідності з ростом концентрації так, що в деякому інтервалі концентрацій l росте при збільшенні концентрації. Така “аномальна” електрична провідність не може бути пояснена з позицій простої електростатичної теорії і вимагає врахування асоціації іонів з утворенням іонних пар, трійників і більш складних частинок. Наприклад, можна передбачити, що при зростанні концентрації розбавленого розчину електроліту АВ спочатку його електрична провідність обумовлена іонами А+ і В-, потім відбувається утворення незаряджених іонних пар (А+В-), а при ще більш високій концентрації – іонних трійників (А+В-А+). У зв’язку з цим ріст концентрації електроліту спочатку веде до зростання електричної провідності, а потім до її зменшення, а далі знову до зростання. В ще більш концентрованих розчинах може відбуватися об’єднання іонних трійників один з одним і з іншими іонами в іще більш складні асоціати, що викликає повторне зниження електропровідності.
Недоліки теорії Дебая-Гюккеля-Онзагера пов’язані з недосконалістю і обмеженістю її теоретичних припущень, яка розглядає лише електростатичну взаємодію іонів і опосередкований вплив оточуючого середовища. В сучасних теоріях концентрованих розчинів електролітів, окрім утворення різних асоціатів, враховується сольватація іонів і їх кінетичні розміри, симетричність розприділення концентрації в іонній атмосфері, що рухається, локальні зміни в’язкості поблизу іонів, електрофоретичне і релаксаційне гальмування і інші ефекти.
Звертає на себе увагу аномально висока рухливість іонів Н+ і ОН-. Для порівняння наведемо значення l¥ для цих та деяких інших іонів (табл. 1)
Таблиця 1.
| Катіони | Рухливість l+,¥×104, См×м2/моль | Аніони | Рухливість l-,¥×104, См×м2/моль |
| H+ | 349,8 | OH¯ | 199,2 |
| K+ | 73,5 | ½SO42¯ | 79,8 |
| Ag+ | 69,1 | Cl¯ | 76,3 |
| к+ | 50,3 | CH3COO¯ | 40,9 |
З таблиці видно, що рухливість Н+ і ОН- значно більша за інші іони. Це дозволяє передбачати, що рух іонів гідроксонію Н3О+ у воді під впливом електричного поля відбувається двома шляхами: за рахунок міграції (тобто руху в напрямку поля разом зі своєю гідратною оболонкою) і перескакування протона від однієї молекули води до іншої в тому ж напрямку за схемою

Іон водню притягується киснем молекули води, на якому зосереджена електронна густина, водневий зв’язок в іоні гідроксонію розривається. Перескакування Н+ до молекулу води веде до утворення нового іону гідроксонію, який не орієнтований відносно негативного електроду. На наступній стадії відбувається орієнтація іону Н3О+, що утворився, а далі все повторюється. При такому (естафетному) механізмі рухливість Н3О+ виявляється значно більшою, ніж коли іон переміщується лише за рахунок міграції. Аналогічним чином пояснюють підвищену рухливість іона гідроксилу.
 Різка відмінність рухливості іона водню і гідроксид-іона від рухливості інших іонів використовується в методі кондуктометричного титрування. Сутність методу полягає в тому, що під час титрування періодично вимірюють електропровідність – об’єм розчину, що пішов на титрування (рис. 75).
Різка відмінність рухливості іона водню і гідроксид-іона від рухливості інших іонів використовується в методі кондуктометричного титрування. Сутність методу полягає в тому, що під час титрування періодично вимірюють електропровідність – об’єм розчину, що пішов на титрування (рис. 75).
Точку еквівалентності визначають за різкою зміною ходу кривої. Метод застосовують при об’ємному аналізі значно розбавлених розчинів, в яких не можуть бути використані забарвлені індикатори. Роль індикатора тут відіграє електропровідність. Наприклад, при титруванні розчину соляної кислоти лугом більш рухливі іони водню заміщуються на менш рухливі, наприклад, іони натрію:
Н+ + Cl¯ + OH¯ → Na+ + Cl¯ + H2O
До додавання лугу у вихідному розчині провідність була обумовлена іонами Н+ і Сl¯. Після додавання невеликої порції лугу частина іонів водню зв’язується гідроксид іонами в малодисоційовану сполуку Н2О. Це веде до заміни частини іонів водню, що володіють високою рухливістю, на іони натрію, які мають набагато меншу рухливість і електропровідність розчину зменшується. Наступне додавання лугу веде до подальшої заміни іонів водню на іони натрію і зменшення електропровідності розчину. Найменше значення електропровідності розчину спостерігається в точці еквівалентності, де всі іони водню замінені на іони натрію. Подальше додавання лугу веде до зростання електричної провідності, так як в розчині наростає концентрація гідроксид-іонів.
Кондуктометричний метод дозволяє розв’язувати і більш складні завдання – одночасне титрування слабкої і сильної кислот лугом, одночасне титрування лугом кислоти і солі, що утворює з іонами ОН¯ нерозчинні сполуки та ін.
Шляхом вимірювання l при різних концентраціях розчину і подальшою екстраполяцією до нульової концентрації можна знайти λ¥.
Якщо виміряти електричну провідність розчину заданої концентрації, то за рівнянням (ХІІІ.3.20) можна розрахувати ступінь дисоціації електроліту в цьому розчині. Якщо одержане значення ступеня дисоціації підставити в рівняння (ХІІІ.1.4),то отримаємо співвідношення
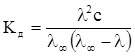 , (ХІІІ.3.24)
, (ХІІІ.3.24)
що дозволяє розрахувати константу дисоціації електроліту за даними електропровідності.
За значенням питомої електропровідності можна визначити розчинність і добуток розчинності важкорозчинної речовини. Добуток розчинності (ДР) – це добуток активностей іонів важкорозчинної речовини в насиченому розчині при даній температурі. Так як насичений розчин важкорозчинної речовини можна вважати безкінечно розбавленим, то добуток активностей можна замінити на добуток рівноважних концентрацій. Якщо малорозчинна сполука KmAn розпадається на катіони Kn+ і аніони Am-, то рівняння для добутку розчинності записується так:
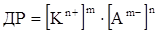 (ХІІІ.3.25)
(ХІІІ.3.25)
Питому електричну провідність насиченого розчину виражають за рівнянням
 (ХІІІ.3.26)
(ХІІІ.3.26)
В наслідок малої концентрації катіонів і аніонів в насиченому розчині важкорозчинної речовини lК і lА в рівнянні можна вважати рівними lК,¥ і lА,¥, а a = 1. Концентрація с є розчинністю S речовини в моль/м3. З цього витікає, що 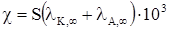 , звідкіля
, звідкіля
 (ХІІІ.3.27)
(ХІІІ.3.27)
Значення lК,¥ і lА,¥, знаходять в довідникових таблицях. При визначенні c сильно розбавлених розчинів необхідно враховувати  , так як ця величина може вносити великі похибки в значення розчинності важкорозчинного електроліту.
, так як ця величина може вносити великі похибки в значення розчинності важкорозчинного електроліту.
Поиск по сайту: