 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электронная оболочка атома
Если человек не понимает проблемы, он пишет много формул, а когда поймет, в чем дело, их остается в лучшем случае две.
Н.Бор
В 1925 г. В. Паули установил квантово-механический закон, называемый принципом Паули, или принципом исключения.
В своей простейшей формулировке он гласит: в любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных энергетических состояниях, определяемых
набором четырех квантовых чисел: главного п, орбитального l, магнитного m и спинового ms.
Применительно к системе электронов в атоме принцип Паули можно записать следующим образом: Z (n, l, m, ms) = О или l, где z (n, l, т, ms) есть число электронов, находящихся в состоянии, описываемом набором квантовых чисел n, l, m, ms. Пользуясь принципом Паули, можно найти максимальное число электронов в атоме, имеющих заданные значения трех (n, l, m), двух (п, l) и одного п квантовых чисел. Принцип Паули сыграл выдающуюся роль в развитии современной атомной и ядерной физики. Так, например, удалось теоретически обосновать периодическую систему элементов Д. И. Менделеева.
В начале XX в. опытами по облучению тонкой фольги а-частицами Э. Резерфорд определил структуру атома. Он показал, что атом имеет планетарную модель, т. е. состоит из плотного положительно заряженного ядра, вокруг которого обращается рыхлая электронная оболочка. В целом атом является электронейтральной элементарной структурой химического элемента. Физический смысл порядкового номера Z-элемента в периодической системе элементов был установлен в планетарной модели атома Резерфорда. Z совпадает с числом положительных элементарных зарядов в ядре, закономерно возрастающих на единицу при переходе от предыдущего элемента к последующему. Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, так называемых валентных, электронов их атомов. Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов. Теория периодической системы основывается на следующих положениях:
а) порядковый номер химического элемента равен общему
числу электронов в атоме данного элемента;
б) состояние электронов в атоме определяется набором их
квантовых чисел n, l, m и ms. Распределение электронов в атоме
по энергетическим состояниям должно удовлетворять принципу
минимума потенциальной энергии: с возрастанием числа элект-
ронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
в) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа п, образуют электронную оболочку, или электронный слой. В зависимости от значений п различают следующие оболочки: К при n = 1, L при n = 2, М при n = 3, N при n = 4, О при п = 5 и т. д. Максимальное число электронов, которые могут находится в оболочках, согласно принципу Паули: в К-оболочке — 2 электрона, в оболочках L, М, N и О соответственно 8, 18, 32 и 50 электронов. В каждой из оболочек электроны распределяются по подгруппам или по-доболочкам, каждая из которых соответствует определенному значению орбитального квантового числа.
В атомной физике принято обозначать электронное состояние в атоме символом nl, указывающим значение двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числами n и l, называются эквивалентными. Число Z эквивалентных электронов указывается показателем степени в символе nl z. Если электроны находятся в некоторых состояниях с определенными значениями квантовых чисел п и l, то считается заданной так называемая электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой: 1s2, 2s2, 2р4. Она показывает, что два электрона находятся в состояниях n = 1 и l = 0, два электрона имеют квантовые числа n = 2 и l = 0 и четыре электрона занимают состояния n = 2 и l = 1.
Порядок заполнения электронных состояний в оболочках атомов, а в пределах одной оболочки — в подгруппах (подоболоч-ках) должен соответствовать последовательности расположения энергетических уровней с данными п и Z. Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния со все более высокой энергией. Для легких атомов этот порядок соответствует тому, что сначала заполняется оболочка с меньшим п и лишь затем должна заполняться электронами следую-
щая оболочка. В пределах одной оболочки сначала заполняются состояния с l = 0, а затем состояния с большими l, вплоть до l = n - 1. Взаимодействие между электронами приводит к тому, что для достаточно больших главных квантовых чисел п состояния с большим п и малым l могут иметь меньшую энергию, т. е. быть энергетически более выгодными, чем состояния с меньшим п, но с большим l. Из изложенного следует, что периодичность химических свойств элементов объясняется повторяемостью электронных конфигураций во внешних электронных подгруппах у атомов родственных элементов.
Исследования спектров излучения разряженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода.
Спектр водорода может быть рассчитан обобщенной формулой, предложенной эмпирически швейцарским ученым И. Бальмером, описывающей все известные тогда линии водорода:
R = 3,29 • 1015с-1 — постоянная Ридберга, где m имеет в каждой данной серии постоянное значение т=1,2,3,4,5,б (определяет серию), п принимает целочисленные значения начиная от m + 1 (определяет отдельные линии этой серии). Исследование более сложных спектров — спектров паров щелочных металлов (например, Li, Na, К) — показало, что они представляются набором незакономерно расположенных линий.
Первая попытка построения качественно новой — квантовой — теории атома была предпринята в 1913 г. датским физиком Нильсом Бором. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, планетарную модель атома Резерфорда и квантовый характер
излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
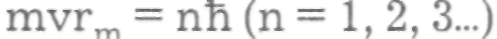 , где m — масса электрона,
, где m — масса электрона,  — скорость по n-й орбите радиуса
— скорость по n-й орбите радиуса 
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) квант излучения с энергией hv = En — Em, равной разности энергий соответствующих стационарных состояний [(Еn и Еm — соответственно энергии стационарных состояний атома до и после излучения (поглощения)]. При Еm < Еn происходит излучение кванта (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот v = (En - Em) / h квантовых переходов и определяет линейчатый спектр атома.
Квантовая механика позволила объяснить вопрос об излучении спектральных линий атомом, находящимся в возбужденном состоянии, а также процессы поглощения излучения, которое падает на атом в полном согласии с опытом. Предположим, что электрон находится в некотором энергетическом состоянии, характеризуемом главным квантовым числом п. Вероятность нахождения электрона в элементе объема dV внутри атома выразится как  . Было показано, что в квантовом состоянии, характеризуемом главным квантовым числом п, вероятность местоположения электрона в атоме не зависит от времени, не изменяется с течением времени. Электрон в таком состоянии не будет совершать колебаний и излучать энергию. Его энергия Еn не будет изменяться. Энергетическое состояние электрона,
. Было показано, что в квантовом состоянии, характеризуемом главным квантовым числом п, вероятность местоположения электрона в атоме не зависит от времени, не изменяется с течением времени. Электрон в таком состоянии не будет совершать колебаний и излучать энергию. Его энергия Еn не будет изменяться. Энергетическое состояние электрона,
характеризуемое определенной энергией Еn, является стационарным. Находясь в этом состоянии, электрон не излучает энергии. Это есть объяснение первого постулата Н. Бора о наличии у атома стационарных состояний, находясь в которых электроны атома не излучают энергии. С точки зрения квантовой механики стационарное состояние атома должно сохраняться как угодно долго, если нет причин, вызывающих изменение энергии атома. Однако опыт показывает, что атом, находящийся в возбужденном энергетическом состоянии, сам собой переходит в нормальное, невозбужденное состояние, излучая свет. Такое излучение, происходящее в отсутствие внешних причин, изменяющих энергию атома, называется самопроизвольным, или спонтанным, излучением. В квантовой физике переход атома из одного состояния в другое, связанный с излучением или поглощением кванта Е = hv, описывается с помощью общего уравнения Шредингера, в котором волновая функция электрона зависит не только от координат, но и от времени, 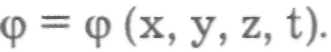
Идеи де Бройля о волновых свойствах микрообъектов были весьма плодотворны, именно на их основе был сформулирован основной закон движения микрочастиц. Его нашел в 1926 г. швейцарский физик Э. Шредингер:

В этом уравнении V (х, у, z) — потенциальная энергия,
m — масса микрочастицы,  — сумма вторых производных по
— сумма вторых производных по
пространственным координатам, h — постоянная Планка, 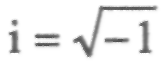
Квантовая механика позволила преодолеть непоследовательность теории Бора. Оказалось, что уравнение Шредингера составлено так удачно, что его решение для электронов в атоме позволяет без всяких постулатов и правил отбора получить все объяснения данных наблюдений. Переход атома из одного состояния в другое означает переход между этими состояниями его оптического электрона, описываемого волновой функцией  . Естественно, что сам спектр излучения состоит из отдельных ли-
. Естественно, что сам спектр излучения состоит из отдельных ли-
ний, соответствующих переходам между дискретными уровнями энергии в атоме и охватывает весьма широкий диапазон частот. Наблюдаемое дискретное излучение атомов охватывает область инфракрасного излучения, видимую область, ультрафиолетовую часть спектра и даже рентгеновский линейчатый спектр (в случае тяжелых атомов). Атомы разных химических элементов обладают различными спектрами излучения. На этом основан спектральный анализ химического состава таких небесных тел, как Солнце и звезды.
Таким образом, в области микромира согласно современной естественно-научной картине мира, на смену "волнам материи" пришли "волны вероятности". Вероятностная трактовка волновой функции отражает присущие микрообъектам элементы случайного в их поведении. Необходимой оказывается лишь вероятность поведения микрообъекта. Это означает, что предсказания в квантовой физике имеют, вообще говоря, вероятностный характер и, следовательно, физика микрообъектов является принципиально статистической теорией. Случаен факт обнаружения электрона в том или ином месте около ядра; вероятность же его обнаружения в данном месте определяется формой и размерами соответствующего "электронного облака".
Вероятность лежит в самой основе квантовой механики и вообще квантовой физики. Академик В. А. Фок писал: "В квантовой механике понятие вероятности есть понятие первичное, оно играет там фундаментальную роль". "Статистические методы в физике, — писал Борн, — по мере развития науки распространялись все больше и больше, и сегодня можно сказать, что современная физика полностью опирается на статистическую основу... Это является событием в истории человеческого мышления, значение которого выходит за пределы самой науки".
Вероятностный подход к описанию явлений микромира совершенно не означает, что движение микрочастиц непредсказуемо и произвольно. Зная волновую функцию, можно определить вероятность появления частицы в любом месте и в любое время. На смену жестко детерминизированным законам классической физики, справедливым в макромире, пришли вероятностные
законы, работающие в микромире. Они являются отражением специфики микрообъектов, проявлением новых свойств материи на уровне ее мельчайших структурных единиц. Принцип соответствия работает и здесь — при переходе к макрообъектам квантово-механический аспект движения становится неощутим из-за малости постоянной Планка п. Динамические законы есть предельный случай более общих вероятностных закономерностей. Последние не являются свидетельством неполноты нашего знания, а отражают глубокое понимание свойств материи на новом качественном уровне.
ВЫВОДЫ
1. Обнаружено, что элементарные частицы могут взаимно превращаться, т. е. не являются "последними кирпичиками" мироздания. Стало ясно, что число элементарных частиц не должно быть особенно большим.
2. В механике микромира уравнение Шредингера для волновой функции играет ту же роль, что и уравнение Ньютона в классической механике. В уравнении, объясняющем поведение электрона в атоме, содержится волновая функция, квадрат модуля которой определяет положение электрона в данной точке в каждый момент времени. Главным открытием квантовой механики является вероятностный характер законов микромира.
3. Частицам вещества в микромире присущ корпускуляр-но-волновой дуализм: в одних явлениях они проявляют волновые свойства, а в других — корпускулярную природу. Поэтому для изучения свойств микромира применяют принцип дополнительности, введенный Н. Бором в 1927 г.
4. Фундаментальным в квантовой теории является принцип неопределенности, определяющий границы применимости классических представлений при описании свойств микромира. Невозможно с одинаковой точностью определить и положение, и импульс микрочастиц.
5. В результате экспериментов по рассеянию а-частиц
Резерфордом была предложена планетарная модель строения
атома. При заполнении электронами орбит в атоме соблюдается
принцип Паули: два электрона не могут находиться в одном и том же энергетическом состоянии.
6. Важнейший философский вывод из квантовой механики заключается в принципиальной неопределенности результатов измерений и, следовательно, невозможности точного предвидения будущего в микромире.
Вопросы для контроля знаний
1. Какие новые открытия в науке опровергли представления об атомах как последних, неделимых частицах материи?
2. Охарактеризуйте строение атома по модели Э. Резерфорда.
3. Что принципиально нового внес в эту модель Н. Бор?
4. Какие частицы называются элементарными и где они были открыты?
5. Какими общими свойствами обладают элементарные частицы?
6. Какие частицы называются кварками и почему они не существуют в свободном состоянии?
7. Что такое вещество и антивещество?
8. Что называют аннигиляцией элементарных частиц?
9. Какие эксперименты доказывают существование волновых свойств у микрочастиц материи?
10. Существуют ли волновые свойства микрочастиц отдельно от корпускулярных? Что означает дуализм микрочастиц?
11. Сформулируйте принцип дополнительности и расскажите, где он применяется.
12. Почему принцип неопределенности служит фундаментом квантовой механики?
13. В какой форме выражаются законы квантовой механики?
14. Каков характер принципа причинности в микромире?
Поиск по сайту: