 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химические процессы
О значительнейших вещах не будем судить слишком быстро.
Гераклит
Химический процесс (от лат. processus — продвижение) представляет собой последовательную смену состояний вещества, тесную связь следующих друг за другом стадий развития, представляющую непрерывное, единое движение. Учение о химических процессах — это область науки, в которой существует наиболее глубокое взаимопроникновение физики, химии и биологии. Химические процессы подразделяются на: гомо- и гетерогенные (в зависимости от агрегатного состояния реагирующих систем), экзо- и эндотермические (в зависимости от количества выделяющейся и поглощаемой теплоты), окислительные, восстановительные (в зависимости от отношения к кислороду) и др.
Все процессы, которые протекают вокруг нас, можно объединить в три большие группы.
1. Самопроизвольные процессы, которые можно использо
вать для получения энергии или совершения работы. Условиями
протекания самопроизвольных процессов или законами термо
динамики, характеризуемыми их, являются: а) в изолированной
системе, т. е. в системе, для которой исключен любой материаль
ный или энергетический обмен с окружающей средой, сумма
всех видов энергии есть величина постоянная; б) изменение
энтальпии (тепловой эффект процесса, АН) зависит только от
вида и состояния исходных веществ и продуктов и не зависит
от пути перехода. Он носит название закона Гесса и сформули
рован им в 1840 г.
2. Процессы, для осуществления которых требуется затрата
энергии или совершение работы.
3. Самоорганизация химической системы, т. е. самопроиз
вольный процесс, проходящий без изменения энергетического
запаса системы, совершается только в направлении, при котором
порядок в системе увеличивается, т. е. где энтропия уменьшается.
Способность к взаимодействию различных химических реагентов определяется не только их атомно-молекулярной структурой, но и условиями протекания химических реакций. Процесс превращения одних веществ в другие называется химической реакцией. К условиям протекания химических процессов относятся прежде всего термодинамические факторы, характеризующие зависимость реакций от температуры, давления и некоторых других условий. На скорость химической реакции также влияют следующие условия и параметры:
1) природа реагирующих веществ (например, щелочные металлы растворяются в воде с образованием щелочей и выделением водорода и реакция протекает при обычных условиях моментально, а цинк, железо и другие реагируют медленно и с образованием оксидов, а благородные металлы не реагируют вообще);
2) температура. При повышении температуры на каждые 10 °С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Со многими веществами кислород начинает реагировать с заметной скоростью уже при обыкновенной температуре (медленное окисление). При повышении температуры начинается бурная реакция (горение);
3) концентрация. Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в 5 раз меньше. Здесь справедлив закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ;
4) площадь поверхности реагирования. Для веществ в твердом состоянии скорость прямо пропорциональна поверхности реагирующих веществ. Железо и сера в твердом состоянии реагируют достаточно быстро лишь при предварительном измельчении и перемешивании: горение хвороста и полена;
5) катализатор. Скорость реакции зависит от катализаторов, веществ которые ускоряют химические реакции, но сами при этом не расходуются. Разложение бертолетовой соли и пероксида водорода ускоряется в присутствии оксида марганца (IV) и др.
Для вступления в химическую реакцию необходимо преодолеть некоторый энергетический барьер, соответствующий энергии активации, возможность накопления которой сильно зависит от температуры. Многие реакции долгое время не могут закончиться. В таком случае говорят, что реакция достигла химического равновесия. Химическая система находится в состоянии равновесия, если выполняются следующие три условия:
1) в системе не происходит энергетических изменений (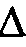 Н = 0);
Н = 0);
2) не происходит изменений степени беспорядка (,  S = 0);
S = 0);
3) не изменяется изобарный потенциал ( J = 0).
J = 0).
Вант-Тофф, используя термодинамический подход, классифицировал химические реакции, а также сформулировал основные положения химической кинетики. Химическая кинетика изучает скорости протекания химических реакций. Ле Шателье сформулировал закон смещения химического равновесия в химических реакциях под влиянием внешних факторов — температуры, давления и др. Согласно принципу Ле Шателье, если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрация), то положение равновесия химической реакции смещается в ту сторону, которая ослабляет данное воздействие.
Химические реакции классифицируют по изменению качества исходных веществ и продуктов реакции на следующие виды:
реакции соединения — реакции, при которых из нескольких веществ образуется одно вещество, более сложное, чем исходные;
реакции разложения — реакции, при которых из одного сложного вещества образуется несколько веществ;
реакции замещения — реакции, при которых атомы одного элемента замещают атом другого элемента в сложном веществе и при этом образуются два новых — простое и сложное;
реакции обмена — реакции, при которых реагирующие вещества обмениваются своими составными частями, в результате
чего из двух сложных веществ образуются два новых сложных вещества.
По тепловому эффекту химические реакции можно подразделить на экзотермические — с выделением теплоты и эндотермические — с поглощением теплоты. С учетом явления катализа реакции могут быть каталитические — с применением катализаторов и некаталитические — без применения катализаторов. По признаку обратимости реакции делят на обратимые и необратимые.
В. Оствальд, исследуя условия химического равновесия, пришел к открытию явления катализа. Оказалось, что в большой степени характер и особенно скорость реакций зависят от кинетических условий, которые определяются наличием катализаторов и других добавок к реагентам, а также влиянием растворителей, стенок реактора и иных условий. Явление катализа — селективного ускорения химических процессов в присутствии веществ (катализаторов), которые принимают участие в промежуточных процессах, но регенерируются в конце реакции, широко используется в промышленности, например фиксация азота и водорода, контактный способ производства серной кислоты и многие другие. Впервые синтез аммиака был осуществлен в 1918 г. на основе работ Габера, К. Боша и А. Митташа с помощью катализатора, представляющего собой металлическое железо с добавками окисей калия и алюминия, при температуре 450-550 °Си давлении 300-1000 атмосфер. В настоящее время большое внимание уделяют применению металлоорганических и металлокомплексных катализаторов, отличающихся высокими селективностью и избирательностью действия. Тот же самый процесс синтеза аммиака при использовании металлоорганического катализатора удалось осуществить при обычной температуре (18 °С) и нормальном атмосферном давлении, что открывает большие перспективы в производстве минеральных азотных удобрений. Особенно велика роль катализа в органическом синтезе. Крупнейшим успехом в этом направлении надо признать получение искусственного синтетического каучука из этилового спирта, осуществленное советским академиком С. В. Лебедевым в 20-х годах XX века.
Ферменты, или биокатализаторы, играют исключительную роль в биологических процессах и технологии веществ растительного и животного происхождения, а также в медицине. В настоящее время известно свыше 750 ферментов, и их число ежегодно увеличивается. Ферменты являются бифункциональными и полифункциональными катализаторами, так как здесь имеет место согласованное воздействие двух или нескольких групп катализаторов различной природы в составе активного центра фермента на поляризацию определенных связей субстрата. Эта же концепция лежит в основе каталитического действия фермента и теории кинетики действия ферментов. Главное отличие ферментов от других катализаторов заключается в исключительно высокой активности и ярко выраженной специфичности.
Самоорганизация химических систем в биологические, их единство и взаимосвязь подтверждает синтез органических соединений из неорганических. В 1824 г. немецкий химик Ф. Велер, ученик Берцелиуса, впервые получил из неорганического дициана N-C-C-N при нагревании его с водой щавелевую кислоту НООС-СООН — органическое соединение. Также было получено новое органическое вещество — мочевина (карбамид) из цианистого аммония. В 1854 г. во Франции М. Бертло синтетическим путем получил жир. Наибольшим успехом химии 50-60-х гг. XX в. явился первый синтез простых белков — гормона инсулина и фермента рибонуклерозы.
Поиск по сайту: