 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Конкурентне інгібування
|
Читайте также: |
При конкурентному інгібуванні інгібітор зв'язується з активним центром ферменту і конкурує за нього з субстратом. Таким чином, конкурентний інгібітор не зв'язується з фермент-субстратным комплексом (ES на рис.1), тобто константа дисоціації фермент-інгібіторного комплексу Ki'>>1.
Конкурентний інгібітор зазвичай структурно схожий з субстратом, проте фермент не здатний каталізувати реакцію у присутності інгібітору через відсутність в останнього необхідних функціональних груп.
Оскільки при цьому субстрат та інгібітор конкурують за місце в активному центрі, цю форму інгібування назвали конкурентною.
Цей метод широко використовується в медицині. Так, для лікування інфекційних захворювань. що викликаються бактеріями, використовують сульфаніламідні препарати. Вони мають структурну схожість з параамінобензойною кислотою, яку бактерія використовує для синтезу фолієвої кислоти, що є складовою частиною ферментів бактерій. Завдяки структурній схожості сульфаніламід блокує дію ферменту шляхом витіснення параамінобензойної кислоти із комплексу з ферментом, що синтезує фолієву кислоту, що гальмує ріст бактерій. Це ж явище використовується в хіміотерапії, при якій знищуються хімічними препаратами збудники хвороби, і не пошкоджуються тканини організму-господаря.
Схема конкурентного інгібування і рівняння Міхаеліса-Ментен для нього виглядають таким чином:

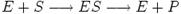
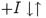

Видно, що при конкурентному інгібуванні максимальна швидкість реакції Vmax не змінюється, а уявна константа Міхаеліса збільшується в  разів.
разів.
Тому в подвійних обернених координатах Лайнуївера-Берка (залежність 1/v0 від 1/[S]) при різних концентраціях інгібітору отримують сімейство прямих з різним нахилом, що перетинаються в одній точці на осі ординат.

 Константу інгібування Ki зазвичай визначають так: проводять ряд вимірів уявної константи Міхаеліса при різних концентраціях інгібітору, потім будують залежність цієї величини від концентрації інгібітору. Тангенс кута нахилу отриманої прямої рівний Km/Ki.
Константу інгібування Ki зазвичай визначають так: проводять ряд вимірів уявної константи Міхаеліса при різних концентраціях інгібітору, потім будують залежність цієї величини від концентрації інгібітору. Тангенс кута нахилу отриманої прямої рівний Km/Ki.
|
Неконкурентне інгібування
Неконкурентний інгібітор не заважає з’єднанню субстрату з ферментом. Він здатний приєднуватися як до вільного ферменту, так і до фермент-субстратного комплексу з однаковою ефективністю.
Неконкурентний інгібітор викликає такі конформаційні зміни, які не дозволяють ферменту перетворювати субстрат на продукт, але не впливає на спорідненість ферменту до субстрату.
Наприклад, цианід зв’язується з іонами металів, що виконують у ферментів роль простетичної групи, і пригнічує активність цих ферментів. Такий тип гальмування каталітичної активності називається ще алостеричним інгібуванням.
Алостеричні інгібітори зв'язуються з окремими ділянками ферменту поза активним центром, викликаючи конформаційні зміни в молекулі ферменту, а саме оборотні зміни в структурі його активно центру. Таке з’єднання призводить до зменшення активності ферменту в результаті зменшення спорідненість ферменту до субстрату. Алостеричні ефекти зустрічаються практично тільки у олігомерних ферментів.
Схема і рівняння Міхаеліса-Ментен в разі неконкурентного інгібування:

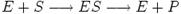


 При неконкурентному інгібуванні константа Міхаеліса не змінюється, а максимальна швидкість реакції зменшується в
При неконкурентному інгібуванні константа Міхаеліса не змінюється, а максимальна швидкість реакції зменшується в  разів. Тому в подвійних обернених координатах сімейство прямих, що відповідають різним концентраціям інгібітору, перетинаються в одній точці на осі абсцис.
разів. Тому в подвійних обернених координатах сімейство прямих, що відповідають різним концентраціям інгібітору, перетинаються в одній точці на осі абсцис.

Неконкурентне інгібування при різних концентраціях інгібітору в подвійних обернених координатах
(1 – [I]=0, 2 – [I]>0, 3 – [I]>[I]2)
Поиск по сайту: