 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Металлы
Цель лекции – ознакомление с физическими свойствами металлов, особенностями металлической связи и кристаллической структуры, со спецификой механических свойств металлов и их взаимосвязи с составом и структурой.
Общая характеристика металлов. В свое время Ломоносов М. В. дал такое определение металлов: «Металлы суть светлые тела, которые ковать можно». В современном понимании это означает, что металлам присущи блеск (высокая отражательная способность) и способность к пластической деформации. Помимо этого, для металлов характерны высокие электро- и теплопроводность, отрицательный температурный коэффициент электропроводности, у многих металлов при температуре, близкой к 0 К, наблюдается сверхпроводимость. Величина электропроводности металлов достигает 106 -108 Ом-1×м-1.
Рассмотрим объяснение наличия таких свойств, рассматривая особенности химической связи в металлах. Атомы металлов имеют в 0-валентном состоянии небольшое (не более четырех) число электронов на внешних электронных уровнях. Ионизационный потенциал, сродство к электрону и электроотрицательность атомов металлов невелики. Напомним, что металлы с заполненными d-уровнями называются простыми, а с незаполненными переходными. Из факта высокой электропроводности металлов следует, что хотя бы часть электронов может перемещаться по всему объему металла. Более того, в металлах концентрация носителей заряда велика и неизменна при изменении температуры. Данные рентгенографии свидетельствуют, что структура металлов характеризуются большими координационными числами и является плотно упакованной. Причиной плотной (к.ч.8) и плотнейшей упаковки атомов (к.ч.12) в кристаллах металлов является специфика металлической связи – ее ненасыщаемость, ненаправленность. В отличие от ковалентных и ионных соединений в металлах небольшое число электронов связывает большое число ядерных центров, а сами электроны могут перемещаться в объеме твердого тела. Иными словами, в металлах имеет место нелокализованная и ненасыщенная, ненаправленная химическая связь.
Итак, при дефиците валентных электронов осуществляется коллективное электронно-атомное взаимодействие, приводящее к возникновению металлической связи. На этой основе в периодической системе можно условно провести вертикальную черту – границу Цинтля между элементами III A и IV A групп (таблица с длинными периодами), слева от которой находятся металлы, т. е. элементы с дефицитом валентных электронов у атомов. Pb, Bi, Po находятся справа от границы, но они тоже относятся к металлам, так как валентные s- электроны атомов свинца, висмута, полония могут попадать на 6 d -орбитали даже в невозбужденном состоянии, но тогда число возможных валентных состояний превышает число электронов. Следовательно, возникает дефицит электронов, и происходит образование плотноупакованных кристаллических структур с металлическим типом связи. Исключением в свете условного деления границей Цинтля является и бор, у которого наблюдается дефицит электронов, но 2 p -орбиталь у него появляется впервые (она кайносимметрична), поэтому велик ионизационный потенциал, затруднено обобществление электронов. В связи с этим более точным делением на металлы и неметаллы является граница по диагонали таблицы от бериллия к астату между элементами бор – алюминий, кремий – германий, мышьяк – сурьма, теллур – полоний. Лантаноиды и актиноиды оказываются слева от этой границы. Все d - и f -элементы в виде простых веществ образуют плотноупакованные кристаллические структуры с доминирующим металлическим типом связи, хотя здесь проявляется и ковалентный вклад, обусловленный наличием внутренних электронных уровней. Для металлов характерны некоторые специфические химические свойства: основные свойства оксидов и гидроксидов, восстановительная активность. Отметим, что деление на металлы и неметаллы относительно, всегда следует иметь в виду, по каким (физическим или химическим) свойствам оно осуществляется, причем существуют и амфотерные металлы (элементы).
В прикладном металловедении металлы подразделяются на две большие группы – черные и цветные. Черные металлы имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость и во многих случаях обладают полиморфизмом. Они подразделяются на металлы подгруппы железа - Fe, Co, Ni и близкий к ним Mn, тугоплавкие с Тпл выше полутора тысяч градусов, урановые металлы (актиниды), редкоземельные (лантантаноиды, а также иттрий и скандий), щелочные и щелочноземельные металлы. Цветные металлы подразделяются на легкие (бериллий, магний, алюминий), благородные (Pt, Pd, Ir, Rh, Os, Ru), легкоплавкие (Zn, Cd, Hg, Sn, Pb, Bi, Tl, Sb, Ga, Ge), выделяют полублагородную медь. Используемая литература [3, 10, 21, 34].
Физические свойства металлов. Согласно зонной теории и представлениям об уровне Ферми (наивысший заполненный при 0 К уровень), высокая электропроводность металлов объясняется движением тех электронов, которые находятся на полузаполненных уровнях вблизи энергии Ферми и составляют, согласно теории Зоммерфельда, свободный электронный газ. Высокая теплопроводность металлов обусловлена как плотнейшей упаковкой атомов в кристаллической решетке, так и особенностями нелокализованной металлической связи. Эти же факторы ответственны за отрицательный температурный коэффициент электропроводности: колебания близко расположенных узлов кристаллической решетки усиливаются с ростом температуры, и резко сказывается торможение движения носителей. Отсюда понятна особенно высокая электропроводность вблизи 0 К. Блеск металлов также обусловлен как плотнейшей упаковкой узлов кристаллической решетки, так и наличием свободных энергетических уровней валентных электронов. Отметим, что визуально высокая отражательная способность выявляется на гладкой (шлифованной) поверхности или в случае мелкозернистых слитков металлов. Вместе с тем необходимо подчеркнуть, что ряд механических свойств (пластичность, ковкость) связан с реальной дефектной структурой металлов, а твердость и жаропрочность некоторых металлов обусловлена особенностями химической связи, в которой наряду с признаками металлической проявляются признаки ковалентной связи.
На рис. 14.1 представлена периодическая зависимость температур плавления ряда простых веществ от порядкового номера элемента. Как видно из рисунка, температура плавления простых веществ в периодах вначале возрастает, затем падает. Наименьшую температуру плавления имеют простые вещества с молекулярной структурой и в особенности одноатомные простые вещества s - и p -элементов VIII группы. Наиболее тугоплавки алмаз и кремний, имеющие атомно-координационные решетки. Из металлов наибольшую температуру плавления имеют простые вещества d -элементов. В малых периодах в пределах группы температуры плавления понижаются, а для d -элементов наблюдается более сложная зависимость. У d -элементов температура плавления с ростом порядкового номера повышается в середине вставных декад (хром, молибден, вольфрам) и понижается в начале и в конце вставных декад (Sc–Y–La и Zn–Cd–Hg). В этом проявляется наличие наряду с металлической признаков ковалентной связи за счет участия d -электронов без перехода электронов в коллективное владение кристалла. В наибольшей мере участвуют в образовании ковалентной связи (донорно-акцепторный механизм) 5 d -электроны. Вклад этой связи особенно велик для атомов d -элементов, способных образовать наибольшее число ковалентных донорно-акцепторных связей (хром, молибден, вольфрам, а также гафний и торий).

Рис.14.1. Периодичность в изменении температур плавления простых веществ
Наличие ковалентной составляющей химической связи обусловливает также твердость металлов. Наиболее тугоплавкие – являются и самыми твердыми. Атомы типичных d -элементов – меди, серебра, золота не имеют вакантных d -орбиталей, не могут участвовать в донорно-акцепторном взаимодействии, а образуемые ими металлы являются мягкими и ковкими. Используемая литература [10, 39]
Кристаллическая структура реальных металлов и их механические свойства. Для металлов характерно в основном три типа упаковок: кубическая объемно центрированная (структурный тип a-Fe, характерен для Li, Na, К, W, V и др.), кубическая, гранецентрированная (структурный тип Сг, характерен для Al, Pt и др.) и гексагональная плотноупакованная, (структурный тип Mg характерен для Zn, Hf и др.), изображенные на рис. 14.2. Они характеризуются координационными числами 8 (тип. a-Fe) и 12 (тип Cu и Mg).
В реальных кристаллах имеется множество дефектов – точечных и протяженных. В чистых металлах наиболее распространены вакансии, линейные дефекты - дислокации. Вакансии ответственны за диффузию, их концентрация может достигать 1–2 ат. %. Дислокации в большой мере ответственны за механические свойства кристаллов – пластичность, прочность. Выплавляемые металлургическим путем слитки металлов и получаемые разными путями металлические покрытия обычно имеют поликристаллическую структуру. По этой причине структура, состав межзеренных границ сильно зависят от условий синтеза и обработки металлов и влияют на свойства последних.

а б

с
Рис.14.2. Типы кристаллической решетки металлов:
а – объемно-центрированная кубическая, число атомов в одной ячейке К ¢ = 1 + 8×1/8 = 2,
число ближайших соседей К = 8; б – гранецентрированная кубическая, число атомов
в одной ячейке К ¢ = 6 × 1/2 + 8 × 1/8 = 4, К = 12; в – гексагональная плотноу-
пакованная, число атомов в одной ячейке К¢ = 3 + 2 × 1/2 + 12 × 1/6 = 6, К = 12
Поскольку наиболее важными для практического использования металлов являются механические свойства, напомним их них. На рис. 14.3 представлена зависимость между приложенным извне к металлическому слитку напряжением (s) и вызванной им относительной деформацией (e). Напряжение появилось под действием нагрузки (Р)
s = Р/S, (14.1)
где(S – площадь сечения). Участок ОА характеризует упругую деформацию, которая исчезает после снятия нагрузки. Закон Гука показывает зависимость между приложенным напряжением и упругой деформацией
s = e × Е, (14.2)
где Е – модуль упругости данного твердого тела. При напряжениях больших, чем соответствует s А на рис.14.3, нарушается пропорциональность между напряжением и деформацией. Напряжение вызывает уже не упругую, а пластическую, т. е. остающуюся после снятия нагрузки деформацию. Ее величина при напряжении s 1 равна отрезку СД. При пластической деформации одна часть кристалла перемещается относительно другой и не возвращается на место после снятия нагрузки. Пластическая деформация сопровождается также дроблением блоков мозаики внутри зерен, несколько изменяется их относительное положение, и между зернами могут возникать пустоты. Рк – критическаянагрузка, а s к – критическая деформация, выше которых образец разрушается; они определяют прочность образца.

Рис.14.3. Изменение деформации в зависимости от напряжения
Величина пластической деформации, предшествующей разрушению, является мерой пластичности и может быть измерена по относительному удлинению d = D l/lо или относительному сужению образца.
Твердость – это сопротивление материала вдавливанию в него другого, более твердого тела (по Виккерсу, вдавливание алмазной пирамидки); количественно она пропорциональна величине отношения нагрузки к площади отпечатка. У цветных металлов она составляет 500 – 1000 мПа. Износостойкость как относительная величина определяется изменением размеров, формы, массы твердого тела при заданных условиях истирания. Внутренние напряжения – это сжимающие или растягивающие силы, действующие внутри твердых тел; они обязаны своим происхождением искажениям кристаллической решетки, примесям, в том числе и расположенным по межзеренным границам, а также различиям в размерах зерен в разных частях твердого тела. Причинами появления внутренних напряжений в слитках металлов являются различие размеров зерен вблизи поверхности и внутри слитков (в объеме слитков зерна крупнее), а также неравномерное распределение примесей вследствие явления ликвации – вытеснения примесей при затвердевании к внешним границам слитков.
Для понимания природы взаимосвязи прочности и пластичности металлов с дислокациями в кристаллах необходимо иметь в виду факты подвижности дислокаций, способности их взаимодействовать друг с другом, а также рождаться под влиянием механических воздействий. Дислокации способны перемещаться в кристаллах, либо как бы диффундируя вдоль плоскостей кристаллической решетки, либо передавая функции экстраплоскости соседней плоскости, образующей совершенную решетку (скольжение). В последнем случае перемещение идет в направлении, перпендикулярном плоскостям. В результате продвижения дислокации через весь кристалл происходит смещение одной части кристалла относительно другой без его разрушения. Кристаллы с дислокациями оказываются менее прочными и более пластичными, чем бездефектные.
Движение дислокаций инициируется тепловыми колебаниями решетки и механическими воздействиями, причем последние приводят не только к перемещению, но и к возникновению дислокаций. Одноименные дислокации при встрече друг с другом отталкиваются, разноименные – аннигилируют. Дислокации могут закрепляться на частицах другой фазы или даже на примесных атомах. Более того, атомы примеси концентрируются в энергетически выгодном для этого месте – вдоль оси дислокации. В таких случаях перемещение одноименных дислокаций приводит к их накоплению в определенных местах кристалла и к образованию так называемых стенок дислокаций. Они мешают дальнейшему перемещению дислокаций. В результате кристалл упрочняется. Такой механизм упрочнения вследствие холодной пластической деформации называют наклепом. Его широко используют в технике. Методами упрочнения металлов является также их легирование, получение образцов с мелкими зернами, термическая обработка, поскольку все они приводят к уменьшению либо подвижности дислокаций, либо их числа. Обратные меры приводят к увеличению пластичности металлов, что необходимо для обеспечения штамповки, протяжки проволоки, изготовления листов металлов и т. д.
Необходимо обратить внимание на влияние межзеренных границ на механические свойства металлов. Так, при малых размерах зерен (микронные и менее) может наблюдаться так называемая сверхпластичность. Она обусловлена перемещением зерен под действием деформации без существенного изменения их формы и без отрыва от образца. Особо мелкозернистые образцы могут обладать также высокой износостойкостью (эффект, подобный самосмазыванию). Крупнокристаллические образцы (диаметр зерен – десятки микрон), наоборот, более пластичны вследствие наличия подвижных дислокаций и являются менее износостойкими. Наличие инородной фазы, в особенности вещества с ковалентным типом химической связи, сегрегированного по межзеренным границам, приводит к увеличению твердости и износостойкости образцов. Используемая литература [3, 21, 24, 34, 37].
Сплавы. Таким образом, примеси в металлах оказывают большое влияние на их механические свойства. Более того, они существенным образом модифицируют важнейшее для практического использования свойство – коррозионную устойчивость. Если примесей немного – не более 4 – 5%, говорят о легированном металле. При более высоком содержании второго металла говорят о сплавах. Если примесью в основном металле является вещество неметаллического происхождения, материал называют композиционным.
Сплавы – это двух- или более компонентные твердые вещества, полученные путем взаимной диффузии элементов в твердом, жидком или газообразном состоянии (при необходимости – с последующей кристаллизацией после диффузии). Принято рассматривать сплавы трех типов: твердые растворы замещения или внедрения, интерметаллические соединения, гетеро-генные сплавы (типа механической смеси). Твердые растворы могут быть с неограниченной или ограниченной растворимостью. В первом случае могут быть любые соотношения компонентов, кристаллическая решетка одного металла плавно переходит в кристаллическую решетку другого. В твердых растворах с ограниченной растворимостью (более частый случай) концентрация растворенного вещества повышается до какого-то предела, затем твердый раствор распадается, и образуются двухфазные смеси. Неограниченной растворимость бывает, если соблюдаются следующие условия:
1) кристаллические решетки компонентов А и В изоморфны (однотипны);
2) близки атомные радиусы;
3) близки химические свойства компонентов.
При невыполнении всех перечисленных условий в комплексе, а соблюдении лишь одного или двух, растворимость ограничена. При затвердевании металлов, не смешивающихся друг с другом ни в жидком, ни в твердом состоянии, образуются две индивидуальные металлические фазы со структурой соответствующих чистых металлов. Например, железо не смешивается со щелочными и щелочноземельными металлами, с серебром, кадмием, ртутью, таллием, висмутом.
Признаками интерметаллических химических соединений являются:
1) постоянство состава, хотя и не всегда;
2) наличие нового типа решетки, отличного от типа решеток сплавляемых компонентов;
3) постоянство температуры кристаллизации;
4) индивидуальные свойства продукта взаимодействия.
Возможно существование химических соединений разных типов. Могут быть соединения, в которых атомы металлов проявляют присущую им валентность: например, Mg2Si, Мg2Sn, Мg3Bi2 и др. Такие соединения образуются между атомами элементов, существенно различающихся по своему положению в периодической системе и следовательно, по электроотри-цательности.
Для более близких по порядковому номеру металлов характерно образование упорядоченных твердых растворов разных типов, обладающих признаками как химических соединений, так и неупорядоченных растворов. Примером являются так называемые электронные соединения (фазы Юм-Розери), в которых соблюдаются определенные соотношения между числом валентных электронов и числом атомов. Например, в ряду с указанным соотношением, равным 3/2, бинарные сплавы имеют объемно центрированную кубическую решетку (b-фаза); в ряду с соотношением 21/13 – сложную кубическую решетку с 52 атомами на ячейку (g-фаза); при соотношении 7/4 формируется гексагональная решетка (e-фаза). Эти фазы образованы двумя металлами, один из которых Cu, Ag, Au, Fe, Co, Ni, Pd, Pt, а другой – Be, Zn, Cd, Al, Sn или иногда неметалл (Si). Обычно в системе А – В наблюдаются все три фазы. Примерами являются CuSn – b-фаза, Cu5Sn8 – g-фаза, CuSn3 – e-фаза.
Упорядоченными твердыми растворами являются сверхструктуры (сверхрешетки), а также фазы Лавеса. В первых атомы одного элемента занимают только определенные положения в решетке другого (например, центры граней, центр куба и т. д.). Они могут иметь определенную химическую формулу: Cu3Au, CuAu, FeAl и др. Фазы Лавеса общей формулы АВ 2 также можно назвать химическими соединениями. В их состав входят атомы металлов с соотношением радиусов 1,0: 1,2. Они кристаллизуются в сложной кубической или гексагональной решетке с определенным положением атомов А и В (TiCr2, ZrMo2, FeBe2, NiCo2). Фазы Лавеса как упрочняющие интерметаллические фазы в жаропрочных сталях.
Признаками химических соединений, так и твердые растворы, некоторые фазы внедрения, образуемые металлами переходных периодов с неметаллами, атомы которых имеют малый радиус (водород, азот, углерод). В этих фазах также соблюдается определенное соотношение атомов и соответственно они имеют определенную формулу (М 4 Х, М 2 Х, МХ, МХ 2). Многие карбиды и нитриды, встречающиеся в сталях и других сплавах, являются фазами внедрения.
Свойства сплавов можно варьировать в процессах термической обработки. Нагрев, приводящий металл или сплав в более устойчивое (нередко более равновесное) состояние за счет снятия напряжений и повышения однородности состава, а иногда и за счет фазового перехода (без плавления), называют отжигом. Нагрев сплава выше температуры фазового перехода с последующим быстрым охлаждением, в результате которого сохраняются фазы, существующие в равновесных условиях лишь при высоких температурах, называют закалкой. Твердофазные переходы могут протекать без диффузии (например, мартенситные превращения, которые имеют кооперативный характер сдвига атомов на расстояния порядка межатомных). Прогрев закаленного сплава при температурах ниже точки фазового перехода, который способствует превращениям, приближающим его к более устойчивому структурному состоянию, называют отпуском. Следует иметь в виду, что прогрев сплавов приводит к преимущественному испарению более летучих компонентов (обеднение при прогреве латуни цинком).
В настоящее время получено более 300 сплавов, и поиск новых интенсивно продолжается, что дает возможность получать материалы с новыми и важными для практического использования свойствами (например, сверхпластичность, способность к пайке и сварке, жаропрочность, ударная вязкость и др.). Используемая литература [5, 10, 21]
Особенности свойств наноразмерных частиц металлов. Малые частицы металлов с размерами от единиц до десятков нанометров имеют свойства, принципиально отличные от свойств массивного металла, что представляет практическую ценность и привлекает внимание ученых. Наночастицы составляют предмет исследования молодой отрасли науки – нанохимии, или химии наноструктурированных систем.
К особенностям малых частиц металлов относятся: их чрезвычайно высокая каталитическая активность и реакционная способность, взаимодействие этих частиц с носителями, способность к прочной адсорбции и вместе с тем высокая подвижность на поверхности твердых тел, необычные оптические и многие другие свойства. Так, хорошо известны пирофорные свойства ультрадисперсных металлов. Так называемые металл нанесенные катализаторы, представляющие собой наноразмерные частицы на инертных или полупроводниковых носителях, нашли применение в фотографических процессах записи информации и в газочувствительных сенсорах. Малые (коллоидные) частицы ряда металлов применяются в медицине как медикаментозные препараты, обладающие широким спектром действия, а также для проведения различных биохимических исследований.
Малые частицы металлов характеризуются термодинамическими параметрами, отличающимися от параметров массивного металла. Так, электродный потенциал наноразмерных частиц значительно более отрицателен и зависит от размеров частиц, приближаясь с их увеличением к потенциалу массивного металла по закону, описываемому формулой Гиббса–Томсона:
Er0 = E¥0 – 2s V/nF r, (14.3)
где Er0 – равновесный потенциал частицы радиуса r, s – свободная поверхностная энергия, n – число валентных электронов металла, V – молярный объем металла, E¥0 – его стандартный электродный потенциал.
Все энергетические параметры малых частиц металла отличаются от параметров массивных образцов. Так, завышенным является ионизационный потенциал, заниженными – сродство к электрону и энергия связи между атомами металла. С позиций квантовой химии эти факты объясняются тем, что малоатомные кластеры металлов по своему энергетическому состоянию более близки к молекулам: зонная структура отсутствует, имеются связывающие и разрыхляющие орбитали, по-разному заполненные в зависимости от структуры «молекул» и числа атомов в них, причем сказываются четно-нечетные колебания этого числа. Квантовохимические расчеты показывают, что более энергетически выгодными для трех-, четырех атомных кластеров не характерных кристаллических металлов, линейные структуры. По мере увеличения числа атомов в частицах возрастает и число возможных орбиталей, что приводит к формированию из связывающих и разрыхляющих орбиталей двух зон, разделенных зоной запретных энергий. Соответствующая энергетическая диаграмма напоминает построенную для полупроводников. Лишь при значительном увеличении числа атомов (до десятков и сотен тысяч) запрещенная зона постепенно исчезает, а диаграмма приближается к соответствующей для массивного металла.
Адсорбируясь на поверхности полупроводниковых носителей, малые частицы металлов вступают в обмен электронами с носителем. В результате изменяется электродный потенциал полупроводниковой подложки. Например, при адсорбции частиц серебра, платины, палладия на диоксиде титана потенциал подложки сдвигается в отрицательную сторону, что приводит к повышению стабильности частиц металла. Этот эффект используют в современных технологиях получения токопроводящих рисунков из металлов в электронной технике. Так, самые малые частицы серебра обладают наиболее высокой каталитической активностью в реакциях восстановления металлов из растворов. Однако, к сожалению, такие частицы неустойчивы и быстро окисляются Создание частиц именно на поверхности полупроводника позволяет обеспечить не только их высокую активность, но и устойчивость. Такое сочетание свойств обеспечивает возможность создавать малые частицы катализатора на поверхности полупроводниковых носителей (например, TiO2, PbI2) используя фотоэлектроны для восстановления адсорбированных ионов серебра, палладия и др.
Изучение свойств малых частиц – путь к созданию новых поколений приборов электронной техники и нанотехнологиям. Используемая литература [4, 27, 35, 36].
Рассмотрим первый (направленная кристаллизация по методу Бриджмена – Стокбаргера). В лодочку с острым концом, где находится монокристаллическая затравка, загружают шихту и расплавляют ее в горячем отсеке двухзонной печи (рис. 18.1). Далее лодочку медленно перемещают из горячей зоны 1, где температура немного превышает Т пл в более холодную зону 2 с температурой ниже Тпл Наиболее интенсивен теплоотвод в узкой части лодочки, поэтому именно там происходит переохлаждение, достаточное для того, чтобы рос кристалл. Небольшой градиент температур и медленное охлаждение нужны, чтобы не образовывались новые зародыши, а происходил рост только одного кристалла, заполняющего постепенно лодочку. Кроме того, таким образом предотвращают растрескивание кристалла. Недостатками метода является появление внутренних напряжений и дефектов в кристаллах, а также наличие примесей, поступающих из лодочки, неравномерность распределения примесей в объеме монокристаллов.

Рис. 18.1. Схема выращивания
монокристалла методом
Бриджмена-Стокбаргера:
1 и 2 – высоко и низкотемпературные
зоны печи; 3 – лодочка; 4 – монокристал-
лическая затравка; 5 – расплав; 6 – закри-сталлизовавшаяся часть монокристалла
Более совершенным является метод Чохральского, используя который наиболее часто выращивают монокристаллы кремния, германия, арсенида галлия, корунда, алюмо-иттриевого граната. Сущность его состоит в том, что кристалл как бы “вытягивают” из расплава (рис. 18.2). В тигле из кварца, помещенном в керамическую подставку, которая наполнена глиноземом, находится расплав кремния 1. В связи с высокой температурой расплава кварц размягчается и поэтому нужна столь сложная система для сохранения прочности. Система находится в инертной атмосфере (аргон). До поверхности расплава дотрагиваются кристаллической затравкой 4, прикрепленной к штоку 5. После этого шток медленно поднимают, вращая его. Из-за вязкости расплава поверхностное натяжение удерживает столбик из расплава 2 на небольшой высоте над поверхностью основной его массы. Чем выше температура расплава и больше скорость подъема штока, тем ýже столбик. В плоскости 3 над поверхностью расплава температура становится достаточно низкой для кристаллизации. Расплав кристаллизуется на монокристаллической затравке 4. Постепенно на той же высоте 3 кристаллизуются новые порции расплава, а готовый кристалл поднимается. Вращение штока и тигля обеспечивает перемешивание расплава, что нужно для улучшения тепло- и массообмена. Длина получаемых таким методом кристаллов в зависимости от природы и условий выращивания может колебаться от нескольких десятков до сотен миллиметров, диаметр – от 30 до 100 мм и более.

Рис. 18.2. Схема выращивания
монокристалла методом Чохральского:
1 – расплав кремния в тигле из кварца, который
находится в шихте глинозема, помещенной в
керамическую подставку; 2 – столбик расплава
над зеркалом расплава; 3 – фронт кристаллизации;
4 – монокристаллическая затравка; 5 – вращающийся
шток, скорость подъема которого определяет
положение фронта кристаллизации, диаметр столбика
расплава, диаметр кристалла и скорость его роста
Отметим, что обычно выращивают монокристаллы, специально легированные примесью в строго заданном количестве, для придания определенного типа и величины проводимости. Для этого в шихту, из которой готовят расплав, заранее вводят примесь. Поскольку коэффициент распределения примеси между расплавом и растущим кристаллом не равен единице, концентрация примеси в расплаве постепенно изменяется. Как правило, она повышается в расплаве. Вследствие увеличения концентрации примеси в расплаве возрастает ее содержание и в выращиваемом кристалле. В результате распределение примеси не равномерно по длине кристалла. Выравнивание распределения примеси в готовом монокристалле можно обеспечить лишь путем его длительного отжига. Для того чтобы сохранять постоянство состава расплава, его “подпитывают” дополнительными порциями вещества, из которого состоит выращиваемый монокристалл.
Естественно, огромную роль в процессах выращивания монокристаллов играют процессы тепло- и массообмена. Наиболее быстро в процессе роста слитка меняется состав расплава вблизи фронта кристаллизации. Там же повышается температура расплава из-за выделения теплоты кристаллизации. Асимметрия теплового поля вызывает неравномерное распределение примеси по сечению кристалла. По этим причинам особенно важным является перемешивание расплава (путем вращения растущего слитка и тигля), а также тщательный подбор скорости вытягивания.
Метод Киропулоса отличается от метода Чохральского тем, что фронт кристаллизации расположен под поверхностью расплава и постепенно распространяется в глубь расплава. Это достигается путем более сильного охлаждения кристалла и замедления его подъема. Так выращивают крупные кристаллы галогенидов щелочных металлов. Недостатком метода является возможное образование новых, так называемых “паразитных”, кристаллов и изогнутая форма фронта кристаллизации, что вызывает изгиб плоскостей спайности.
Бестигельная зонная плавка также позволяет выращивать монокристаллы в условиях, когда ни расплав, ни кристалл не соприкасаются с лодочкой или тиглем (рис. 18.3).
Для этого вдоль слитка, из которого необходимо вырастить монокристалл, перемещают обогревательное устройство, обеспечивающее плавление слитка в его поперечном сечении. Толщина зоны расплава очень невелика. Перемещение зоны расплава начинают от монокристаллической затравки, на поверхности которой из переохлаждаемого (при удалении нагревательного элемента) расплава происходит кристаллизация. Затравка как бы разрастается в направлении перемещения расплавленной зоны.
Все перечисленные методы пригодны для выращивания монокристаллов веществ с относительно невысокими температурами плавления (как правило, ниже 1200 оС), а также с относительно небольшим давлением пара компонентов, составляющих вещество кристалла. Для тугоплавких веществ (рубина, шпинелей, рутила) используют бестигельный метод Вернейля (рис. 18.4).

Рис. 18.3. Схема установки для
бестигельной зонной плавки:
1 – стержень из кремния, 2 – вращающиеся
штоки, 3 – кварцевая труба, 4 – вакуум или
инертная атмосфера, 5 – индуктор, 6 – расплав-
ленная зона, 7 – очищенная часть кристалла

Рис. 18.4. Схема аппарата для
выращивания монокристаллов
методом Вернейля:
1 – бункер, 2 – монокристалл, 3 – печь,
4 – свеча, 5 – механизм опускания,
6 – механизм встряхивания
Вещество в виде порошка с размером частиц 2 – 100 мкм из бункера 1 подается через кислородно-водородное пламя, в котором образуются капельки расплава, не загрязненного посторонними веществами, на верхний оплавленный конец затравочного монокристалла 2, медленно опускающегося с помощью механизма 5. Таким образом, можно вырастить монокристаллы веществ, не разлагающихся при плавлении и не содержащих летучие компоненты. Используемая литература [3].
Выращивание монокристаллов из растворов и расплавов-растворов. Выращивание монокристаллов из растворов и расплавов-растворов широко применяется, если требуется получить кристаллы тугоплавкого вещества или синтезировать не простое, а сложное вещество. Получить из раствора-расплава монокристалл заданного состава особенно сложно, если необходимое вещество образуется в результате химического взаимодействия растворенного вещества и растворителя. Например, выращивание монокристаллов арсенида галлия или теллурида кадмия из расплавов, содержащих галлий и мышьяк или кадмий и теллур. Не менее сложным является получение из раствора-расплава вещества А, легированного примесью В в заданном количестве.
Основные пути обеспечения кристаллизации: 1) охлаждение насыщенных растворов; 2) подпитка из твердой, жидкой или газообразной фазы; 3) испарение растворителя.
К растворителям предъявляются строгие требования: 1) растворитель должен снижать температуру начала кристаллизации; 2) уже при невысоких температурах должна быть высокой растворимость кристаллизующегося вещества; 3) растворитель должен иметь небольшое давление пара в области температур, в которой проводится кристаллизация; 4) растворитель должен иметь небольшую вязкость; 5) растворитель либо должен обеспечивать требуемое легирование, либо быть электрически неактивной примесью, если получают кристаллы полупроводника.
Выращивание из растворов возможно тремя способами: низкотемпературным (растворители – вода, спирты, растворы кислот или щелочей и др.), гидротермальным и высокотемпературным (растворители – расплавленные соли и др.). Низкотемпературный кристаллизатор представляет собой сосуд с раствором 1, в котором создается пересыщение, необходимое для роста кристаллов 2 путем медленного снижения температуры или испарением растворителя (рис. 18.5). Этот метод используют для получения крупных кристаллов сегнетовой соли, дигидрофосфата калия, нафталина и др. Реже подобный кристаллизатор применяют для выращивания кристаллов труднорастворимых веществ путем встречной диффузии. Для этого в растворитель на достаточно большом расстоянии друг от друга помещают бюксы, в которых находятся необходимые для протекания химической обменной реакции реагенты в твердом состоянии (например, щавелевая кислота и нитрат серебра). В процессе медленного растворения концентрации ионов достигают предела раство-римости. Начинается кристаллизация (в приведенном примере – оксалат серебра), протекающая в условиях минимального пересыщения, что обеспечивает рост немногих крупных кристаллов.

Рис. 18.5. Схема низкотемпера-
турного кристаллизатора:
1 – раствор, 2 – кристалл, 3 – нагреватель,
4 – термостат, 5 – мешалка, 6 – контактный
термометр, 7 – терморегулятор
Гидротермальный метод основан на зависимости растворимости вещества в водных растворах от давления и температуры. Необходимое пересыщение создают за счет высокого давления (до 300 МПа) и перепада температуры между верхней (~250 оС) и нижней (~500 оС) частями автоклава (рис. 18.6). Перенос вещества осуществляется конвективным перемешиванием. Такой метод используют в основном для выращивания монокристаллов кварца. В этом случае для увеличения концентрации растворенного диоксида кремния и ускорения процесса роста монокристалла в систему добавляют гидроксид натрия.

Рис. 18.6. Схема автоклава для
гидротермального синтеза:
1 – раствор, 2 – монокристал,
3 – печь, 4 – исходное вещество
Рассмотрим несколько вариантов методов выращивания кристаллов из растворов–расплавов при относительно высоких температурах. Наиболее простым случаем является получение монокристаллов стехиометрических соединений, имеющих ограниченную растворимость или не растворимых в расплаве. Примером может служить выращивание кристаллов антимонида галлия из раствора-расплава сурьмы в галлии. Этой системе соответствует дистектическая диаграмма состояний, на которой отсутствуют области твердых растворов, представленная в общем виде для соединений типа А III В V на рис. 18.7. Для выращивания кристаллов GaSb готовят шихту из смеси галлия с сурьмой в молярном отношении 1:1, расплавляют ее при температуре, немного превышающей температуру плавления антимонида галлиия, что необходимо для гомогенизации системы, а затем обеспечивают термодинамическое условие кристаллизации – переохлаждение. Медленное охлаждение продолжают вплоть до температуры эвтектики GaSb–Sb, при этом кристаллизуется только антимонид галлия.

Рис.18.7. Диаграмма состояния система
А-В с пологим пиком на линии ликвидуса
При соблюдении определенных условий выращивание монокристаллов возможно методами Бриджмена–Стокбаргера, Чохральского, зонной плавки. Так, своеобразным вариантом метода зонной плавки является выращивание монокристаллов арсенида галлия из раствора мышьяка в галлии с использованием приема подпитки (рис. 18.8). В данном случае условие кристаллизации обеспечивается путем создания пересыщения за счет диффузии атомов мышьяка из более горячей зоны 1, содержащей шихту арсенида галлия, в зону жидкого галлия 2 к монокристаллической затравке и растущему монокристаллу 3. Пересыщение расплава можно достичь также путем его подпитки через паровую фазу. В таком случае монокристаллическую затравку помещают в расплав галлия и насыщают этот расплав мышьяком из паровой фазы.

Рис. 18.8. Схема получения монокристаллов арсенида галлия
подпиткой через расплав-раствор мышьяка в галлии:
1 и 2 – температурные зоны; 3 – термопары; 4 – печь;
5 – мышьяк; 6 – лодочка с галлием; 7 – кварцевая ампула
Сложнее получить монокристаллы нестехиометрических соединений заданного состава (например, теллурида кадмия). В таких случаях в системе необходимо регулировать давление пара компонентов (кадмия и теллура). Так, при получении кристаллов CdTe стехиометрического состава парциальное давление пара каждого компонента следует обеспечить равным давлению пара над соединением заданного состава при температуре кристаллизации.
К высокотемпературному методу кристаллизации относится также выращивание кристаллов из расплава, в котором растворитель не входит в состав кристаллизующегося вещества, а используется как флюс для понижения температуры плавления и перевода вещества в жидкую фазу. Таким методом происходит выращивание кристаллов титаната бария из расплава во фториде калия. KF является инертным растворителем, на диаграмме состояний (рис. 18.9) отсутствует область твердых растворов. Кристаллизацию кубической модификации BaTiO3 выгодно вести при условиях, соответствующих участку АВ на кривой ликвидуса, поскольку именно этот участок в сравнении с CD является наиболее пологим (сильная зависимость растворимости от температуры). В качестве технических приемов можно использовать методы направленной кристал-лизации и вытягивания из расплава. В обоих случаях выращенный кристалл можно убрать из системы до того момента, когда начнет образовываться твердая фаза нежелательного состава.
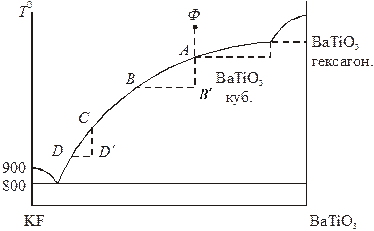
Рис. 18.9. Схема диаграммы состояния
системы титанат бария – фторид калия
Выращивание кристаллов из паровой фазы. Из паровой фазы выращивают кристаллы тугоплавких веществ с достаточно высоким парциальным давлением пара компонентов. Термоди-намическим условием кристаллизации из паровой фазы является создание пересыщения: D р = р – рs, где Р – давление, рs – давление в насыщенной системе, а Dm = КТ ln Р/Рs= KT ln Kp.
Способами создания пересыщенного пара могут быть:
а) возгонка при атмосферном давлении (необходимым является повышение температуры);
б) испарение в вакууме (термическое или под действием пучка ионов – катодное распыление);
в) парофазные методы с использованием химических реакций.
Для выращивания монокристаллов величина пересыщения должна быть минимальной, но в этих условиях мала также скорость роста. По этим причинам получение монокристаллов из паровой фазы – медленный процесс, и вырастить столь же крупные кристаллы, как из расплавов, не удается. Из перечисленных методов создания нужного для выращивания монокристаллов пересыщения в паровой фазе практически пригодными оказываются парофазные реакции. Другие из указанных методов позволяют получать лишь тонкие монокристаллические слои, которые принято называть эпитаксиальными пленками. Их осаждение будет рассмотрено в следующей лекции.
Технологическим приемом выращивания монокристаллов с использованием парофазных реакций является синтез в закрытой ампуле или в открытой трубе в потоке газа-носителя, обеспечи-вающего подвод реагентов (так называемые газотранспортные реакции).
Примером выращивания монокристаллов в закрытой ампуле является получение монокристаллов халькогенидов свинца, цинка (рис. 18.10).

Рис. 18.10. Схема, иллюстрирующая выращивание
монокристалла сульфида свинца в кварцевой закрытой ампуле:
1 - вакуум, 2 - летучий компонент, 3 - заслонка, 4 - кристалл.
Поскольку требуется достижение необходимых давлений пара металла (свинца) и халькогена (серы), различающихся по величине, но соответствующих парциальным давлениям этих компонентов над кристал-лическим сульфидом свинца при температуре его синтеза, то исходные вещества приходится размещать в разных местах ампулы на достаточном удалении друг от друга. Это дает возможность раздельно регулировать температуру, определяющую нужное давление пара компонентов. Пары диффундируют сквозь полупроницаемую мембрану к монокристаллической затравке, где конденсируются и взаимодействуют с образованием сульфида свинца.
Аналогичным образом можно вырастить монокристаллы кремния на затравке, используя реакцию диспропорционирования газообразного SiI2, получаемого в той же ампуле иодированием поликристаллического кремния при 1100 оС. Образующийся SiI2 подвергается диспропорционированию на монокристаллической кремниевой подложке, имеющей более низкую, чем пар, температуру (950 оС). Образующийся при этом SiI4 испаряется и диффундирует вследствие градиента концентрации к исходному кремнию. Протекающие реакции описываются уравнениями:
Si + I2 ↔ SiI2 (18.1)
SiI2 ↔ Si + SiI4 (18.2)
Недостатками метода выращивания кристаллов из паровой фазы в ампулах являются затруднения в раздельном регулировании температуры реагентов и растущих кристаллов, быстрое истощение реагентов, большой расход кварца – обычного материала ампул. Более производительным является метод газотранспортных реакций. В отличие от условий, соблюдение которых необходимо при осаждении пленок, для выращивания монокристаллов требуются более низкие пересыщения (мольные доли компонентов в парофазной смеси) и наличие монокристаллической подложки, поддерживаемой при достаточно высокой для протекания кристаллизационных процессов температуре. Используемая литература [3, 12, 38].
Очистка монокристаллов. Получение особо чистых материалов представляет собой чрезвычайно трудную научно-техническую задачу. Ее решение невозможно без применения глубоких знаний в области химии, причем не только прикладной, но и фундаментальной – неорганической, физической, аналитической, кристаллохимии и др. Очистить вещество А от примеси В можно, казалось бы, концентрируя примесь в небольшой части общего объема. Однако это термодинамически невыгодно, поскольку при концентрировании примеси в однофазной системе без изменения агрегатного состояния вещества энтропия уменьшается, а свободная энергия системы соответственно увеличивается. Для осуществления очистки необходимо изменение агрегатного состояния части вещества А, т. е. образование системы из двух фаз. Примесь В перераспределяется между ними в разной концентрации. Коэффициент распределения примеси К характеризует отношение концентрации примеси в твердой фазе к соответствующей концентрации в жидкой фазе. Он измеряется после установления равновесия и зависит не только от природы вещества, но и от температуры. В зависимости от природы вещества А и примеси В, а, значит, и от значения коэффициента перераспределения, уменьшить концентрацию примеси можно в несколько раз, а иногда в 1000 или даже 10 000 раз (К = 10-3–10-4). В случаях, когда концентрация примеси в системе твердое–жидкое различается на три порядка и более, имеет смысл проводить очистку методами направленной кристаллизации или зонной плавки. Техника этих приемов аналогична описанной выше для выращивания монокристаллов, а распределение примесей в очищаемом слитке представлено на рис. 18.11.
Если коэффициент распределения близок к единице, то использование системы твердое – расплав для очистки неэффективно. Можно попытаться очистить вещество А, используя равновесие в системе твердое – пар. Такой способ очистки эффективен при большом различии давления насыщенных паров вещества А и примеси В. Естественно, при прогнозировании степени очистки следует учитывать и мольную долю примеси В, используя закон Рауля. Если парциальные давления паров вещества А и примеси В в системе твердое – пар близки, то и этот метод неэффективен.

a б в
Рис. 18.11. Распределение примесей в кристалле после его очистки:
а – исходный кристалл, б – очистка методом направленной кристаллизации,
в – очистка градиентной зонной плавкой (первое прохождение зоны)
Наиболее надежен, хотя и не столь короток, третий путь – различные химические превращения, которые помогают отделить примесь В от вещества А. При этом можно использовать реакции образования труднорастворимых или получения летучих веществ. Особое распространение получили газотранспортные реакции. Транспортными называют обратимые гетерогенные реакции, при помощи которых осуществляется массоперенос вещества либо из более горячей зоны в более холодную при наличии градиента температуры, либо из области большего давления в область меньшего давления пара при наличии между этими зонами градиента концентрации. Очищаемое вещество, находясь в твердом состоянии, реагирует, в отличие от примесей, с паром или газом-носителем с образованием летучих соединений. Последние переносятся в зону, где разлагаются с образованием чистого вещества А. Так происходит очистка кремния путем перевода его в летучий и способный к диспропорционированию SiI2 или очистка арсенида галлия в токе водорода и хлорида водорода. В последнем процессе образуются летучие GaCl3 и мышьяк, которые в атмосфере водорода взаимодействуют с образованием чистого арсенида галлия.
Рассмотрим более подробно путь очистки полупроводникового материала на примере кремния, который с конца 50-х годов XX в. стал ведущим полупроводниковым материалом благодаря не только полупро-водниковым свойствам, но и в значительной мере вследствие открытия способа его эффективной очистки методом бестигельной зонной плавки. По распространенности кремний занимает второе место после кислорода. Земная кора более чем на 50 % состоит из оксида кремния, который служит основным сырьем для получения технического кремния. Последний получают восстановлением кремнезема углеродом (коксом) в электропечах при 1500 – 1750 оС в соответствии с уравнением реакции
SiO2 + C = Si + CO2. (18.3)
При наличии в кремнеземе оксидов металлов (наиболее часто – железа) образуется продукт совместного восстановления, например ферросилиций:
SiO2 + 2Fe2O3 + 4C = Si + 4Fe + 4CO2. (18.4)
Кремний нерастворим в кислотах и это свойство используют для его очистки от металлов. Получить кремний полупроводниковой чистоты при использовании этих реакций практически невозможно. Содержание примеси в нем достигает 1–7 %. Гораздо проще и эффективнее подвергать глубокой очистке соединения кремния: галогениды, силаны или их производные и т. д. Поэтому технический кремний химическим путем переводят в какое-либо его производное – SiCl4, SiHCl3 или SiH4, причем важно, чтобы синтезируемое соединение было жидким или газообразным при стандартных условиях. Это дает возможность очистки соединения от других веществ физическим методом, например путем ректификации. Метод осложняется взрывоопасностью смесей трихлорсилана и особенно силана с воздухом.
Тетрахлорид кремния получают хлорированием технического кремния или высокопроцентного ферросилиция (до 90–96 % Si) в стальной аппаратуре при 800–900 °С:
Si +2Cl2 = SiCl4 , (18.5)
2Fe + 3Cl2 = 2FeCl3 . (18.6)
Трихлорсилан получают действием сухого хлористого водорода на технический размолотый кремний при 350–400 °С в соответствии с уравнением реакции:
Si + 3HCl = SiHCl3 + H2. (18.7)
Силан получают взаимодействием тетрахлорида кремния с алюмогидридом лития в эфирном растворе, причем для этого вначале нужно получить алюмогидрид лития. Соответствующие этим превращениям уравнения реакций:
2Li + H2 = 2LiН, (18.8)
2Al + 3Cl2 = 2AlCl3, (18.9)
4LiH + AlCl3 = LiAlH4 + 3LiCl, (18.10)
LiAlH4 + SiCl4 = SiH4 + LiCl + AlCl3. (18.11)
Возможна и другая цепочка превращений – через разложение триэтоксисилана:
SiHCl3 + 3 C2H5OH = SiH(OC2H5)3 + 3 HCl, (18.12)
4 SiH(OC2H5)3 = SiH4 + 3 Si(OC2H5)4. (18.13)
Из тетрахлорида и трихлорида силана кремний получают восстановлением водородом при 10001100 °С в соответствии с суммарными уравнениями, не отражающими отдельных стадий процесса:
SiCl4 + 2H2 = Si + 4HCl (18.14)
SiHCl3 + H2 = Si + 3HCl (18.15)
Наиболее чистый кремний получают термическим разложением моносилана при 600700 °С на нагретых кремниевых пластинах:
SiH4 = Si + 2H2 (18.16)
Многие указанные реакции являются обратимыми. Направление их протекания и выход продукта определяются условиями проведения реакций. В ряде случаев химическое равновесие сдвигают в сторону образования продукта и достигают полноты превращения, эвакуируя продукт из зоны реакции. Вышеприведенные уравнения реакций даны со знаком равенства, и проблемы их обратимости для упрощения и сокращения текста не обсуждаются.
Чистота кремния-сырца, полученного указанным способом, недостаточна для выращивания легированных монокристаллов в электронной промышленности. Поэтому дальнейшую очистку проводят физическим методом – бестигельной зонной плавкой. В соответствии с законом перераспределения, о котором уже говорилось, примеси из кристалла кремния диффундируют в расплавленную зону, которую постепенно перемещают (сверху вниз на рис. 18.3). Концентрация растворенных примесей в зоне увеличивается по мере очистки все большей части кремниевого стержня, и дальнейшая очистка становится невозможной. Таким образом, первое прохождение зоны обеспечивает хорошую очистку лишь части стержня, равной ширине расплавленной зоны. Концентрация примесей в средней части стержня остается без изменения, а в конце стержня накапливается избыток примеси (рис. 18.11). Прохождение расплавленной зоны повторяют многократно в одном и том же направлении. С каждым разом глубокой очистке подвергается все большая часть стержня.
Второе место после кремния в производстве интегральных микросхем (ИС) занимает арсенид галлия. Он имеет большую по сравнению с германием и кремнием ширину запрещенной зоны (D Е = 0,8; 1,2 и 1,4 эВ соответственно). D Е арсенида галлия больше, чем у полупроводниковых соединений, таких как GaSb, InAs, InSb. Эта особенность обеспечивает возможность работы приборов на основе GaAs при высоких температурах, а значит, в интенсивном режиме работы. Уже отмечавшаяся выше большая подвижность носителей в кристаллах арсенида галлия обеспечивает быстродействие приборов. Приведем для сравнения значения подвижности носителей в кремнии, германии и арсениде галлия, которые равны 1500, 3900 и 700012000 см2/В ∙ с, соответственно. Умеренная температура плавления GaAs, равная 1237 оС, а также возможность предотвратить его разложение при нагревании путем поддерживания давления мышьяка над расплавом порядка 10 000 Па позволяют выращивать монокристаллы этого вещества и очищать их методами зонной плавки или направленной кристаллизации без разложения. Казалось бы, фосфиды алюминия и галлия (AlP, GaP), а также антимонид алюминия (AlSb) могут представлять интерес для электроники, тем более что алюминий является относительно дешевым сырьем. Однако указанные фосфиды имеют более высокую температуру плавления, чем арсенид галлия, и, кроме того, они могут быть синтезированы лишь при большом давлении паров фосфора из-за его чрезвычайной летучести. Антимонид алюминия является недостаточно устойчивым химически и легко гидролизуется с выделением гидроксида алюминия и стибина, быстро разлагающегося на сурьму и водород:
2AlSb + 6H2O = 2Al(OH)3 + 2SbH3, (18.17)
2SbH3 = 2Sb + 3H2. (18.18)
Кроме того, подвижность носителей в случае всех указанных соединений A III B V (А и В - элементы III и V группы периодической системы) ниже, чем у арсенида галлия, хотя ширина запрещенной зоны колеблется в пределах 1,3–2,4 эВ. Полупроводниковые соединения A II B IV (например, ZnS, CdS, CdTe) также имеют небольшую подвижность носителей (140, 350 и 1800 см2/В соответственно). Таким образом, арсенид галлия выгодно отличается от большинства полупроводников совокупностью своих физических и химических свойств. Он перспективен для изготовления различных типов диодов и транзисторов, а также ИС, применяемых в оптоэлектронике и в технике сверхвысоких частот.
Для синтеза GaAs с целью использования в электронной технике, как уже отмечалось выше, необходимы очень чистые галлий и мышьяк. Последний очищают от сопутствующих ему простых веществ путем многократной перегонки в вакууме, галлий после зонной очистки рафинируют электроосаждением на катоде из раствора в соответствии с уравнениями реакций:
GaCl3 + 6H2O = Ga(H2O)63+ + 3 Cl-, (18.19)
Ga(H2O)63+ + 3e = Ga + 6 H2O. (18.20)
Поскольку соединения галлия сильно гидролизуются, его электровосстановление проводят только в сильнокислых растворах. При этом побочным продуктом является водород:
2Н+ + 2е = Н2 . (18.21)
Итак, наиболее действенным способом очистки являются химические превращения, позволяющие разделить основное вещество и примесь. Физические методы очистки дают ощутимый результат, если основное вещество и примесь имеют существенные различия в давлении паров (разделение производят методом возгонки), а также если коэффициент распределения примеси в твердой и жидкой фазах различается более чем на два порядка. В последнем случае очистку производят методами направленной кристаллизации или градиентной зонной плавки. При прогнозировании возможности очистки вещества физическими методами следует иметь в виду, что вещества, являющиеся ближайшими химическими аналогами, близки, как правило, и по своим физическим свойствам. Используемая литература [12, 19, 32, 38, 40].
Поиск по сайту: