 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Основания
|
Читайте также: |
Основания – это сложные вещества, состоящие из атомов металла и одой или нескольких гидроксильных групп.
Названия образуют с помощью слова <гидроксид>, к которому добавляется название металла в родительном падеже. Для гидроксидов металлов с переменной валентностью ее следует указать.
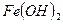 - гидроксид железа (II)
- гидроксид железа (II)
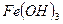 - гидроксид железа (III)
- гидроксид железа (III)
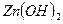 - гидроксид цинка
- гидроксид цинка
Соли.
Соли – продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения группы ОН- в основании на кислотный остаток.
Соли:
1) Средние (NaCl, Na2SO4, Fe3(PO4)2).
2) Кислые (NaHCO3, Ca(HSO4)2, Fe(HPO4)3 ).
3) Основные (FeOHCl, (CaOH)2SO4).
4) Двойные (CaCO3* MgCO3).
5) Смешанные (Na3CO3(HCO3)).
6) Комплексные (K4[Fe(CN)6]).
Номенклатура:
1) средние соли
кислотный остаток + название Ме (валентность Ме).
Fe2(SO4)3
Сульфат железа (III)
2) кислые соли
гидро + кислотный остаток + название Ме (валентность Ме).
NaHSO4 – гидросульфат Na.
Fe(H2PO4)2 – дигидрофостфат Fe(II).
3) основные соли
кислотный остаток + гидроксо + Ме (валентность Ме).
CaOHCl
Хлорид гидроксокальция
(Al(OH)2)2SO4
сульфат дигидроксоалюминия
4) двойные соли
кислотный остаток + Ме + Ме
KAl(SO4)2 – сульфаталлюминия-калия
5) смешанные соли
Na3CO3(HCO3) – гидрокарбонат-карбонат натрия
6) комплексные соли
K4[Fe(CN)6] – гексоцианоферрат(III) калия
Получение:
1) метод прямого синтеза
Mg + Cl2 → MgCl2
2) активный Ме + кислота
Mg + 2HCl → MgCl2 + H2↑
3) малоактивный Ме с концентрированными кислотами (H2SO4 + HNO3).
Cu + H2SO4 (k) → CaSO4 + SO2↑+ H2O
4) основной оксид + кислота
CaO + 2HCl → CaCl2 + H2O
5) основание + кислота
Ca(OH)2 + HCl → CaCl2 + H2O
6) основной оксид + кислотный оксид
CaO + CO2 → CaCO3
7) основание + кислотный оксид
Ca(OH)2 + CO2 → CaCO3 + H2O
8) основание + кислота
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
9) соль + кислота
Na2SiO3 + HCl → NaCl + H2SiO3↓
10) соль + основание
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
11) соль + соль
AgNO3 + NaCl → AgCl↓ + NaNO3
Химические свойства:
Соли взаимодействуют с Ме, кислотами, основаниями и между собой (уравнения реакций смотрите выше).
При нагревании соли аммония, малоактивных Ме, слабых кислот и кислот, в которых элементы проявляют максимальную валентность, разлагаются.
NH4Cl → NH3↑ + HCl
Хлорид аммония
AgNO3 → Ag + O2 + NO2
CaCO3 → CaO + CO2↑
KNO3 → KNO2 + O2
Генетическая связь основных классов неорганических соединений.
−−−−−−−−Элементы −−−−−−−−−−
↓ ↓ ↓
Ме амфотерные элементы неМе
↓ ↓ ↓
осн.оксиды амфотерные оксиды кислот.оксиды
↓ ↓ ↓
основания амфотерные гидроксиды кислоты
↓ ↓ ↓
соли
Поиск по сайту: