 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Примеры решения задач. Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл.14.1)
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл.14.1). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта – в растворе с концентрацией 0,1 моль/л.
Таблица 14.1Стандартные электродные потенциалы (E0) некоторых металлов (ряд напряжений).
| Электрод | E0, В | Электрод | E0, В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg22/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Решение. Электродный потенциал металла (E) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
E=E0+  lgC,
lgC,
где E0 – стандартный электродный потенциал;
n – число электронов, принимающих участие в процессе;
C – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/n;
E0 для никеля и кобальта соответственно равны – 0,25 и – 0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
ENi2+/Ni= -0,25 + 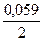 lg10-3= - 0,339 В,
lg10-3= - 0,339 В,
ECo2+/Co= - 0,277+ 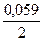 lg10-1= - 0,307 В.
lg10-1= - 0,307 В.
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи решаются также на основании уравнения Нернста (см. пример 1):
- 2,41= - 2,37+ 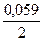 lgC,
lgC,
- 0,04=0,0295lgC,
lgC= -  = - 1,3559= 2,6441,
= - 1,3559= 2,6441,
CMg2+=4,4∙10-2 моль/л.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнения Окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента:
(-)Mg│Mg2+││Zn2+│Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс
Mg0 – 2e=Mg2+ (1)
Цинк, потенциал которого -0,763 В, - катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2++2e= Zn0, (2)
Уравнение окислительно-восстановительной реакции, характеризующие работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg+Zn2+=Mg2++Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС= E0 Zn2+/Zn – E0 Mg2+/Mg= - 0,763-(-2,37)=1,607 В.
Поиск по сайту: