 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Пример приготовления растворов необходимой концентрации различными способами
Пример 1. Определите массовую долю (в %) хлорида натрия в растворе, содержащем 80 г соли в 500 г раствора.
Решение: Массовая доля выражается соотношением:

Следовательно  = (80/500)*100= 16 %.
= (80/500)*100= 16 %.
Пример 2. Сколько граммов воды надо прибавить к 800 г 60 % раствора H2SO4 для получения 40 % раствора?
Решение: Обозначим массу воды, которую требуется прибавить, через Х. Тогда исходя из формулы

запишем: [800*0,6/(800 + Х)]*100, откуда Х = 400 г Н2О.
Пример 3. 500 мл раствора H2SO4 содержит 196 г H2SO4. Определите молярную и эквивалентную концентрацию раствора H2SO4.
Решение: 
 = 98 г/моль,
= 98 г/моль,
М – молярная масса,
См= 196/(98*0.5)= 4 моль/л, где  = 49 г/моль,
= 49 г/моль,
Сн= 196/(49*0.5)= 8н, то есть 8 эквивалентов в 1 л раствора.
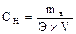
Пример 4. Определите эквивалентную и молярную концентрации 10% раствора Na2CO3, плотность которого 1,102 кг/м3.
Решение: Молярная и эквивалентная массы составляют:  =106 г/моль,
=106 г/моль,  =54 г/моль. Поскольку молярная и эквивалентная концентрации относятся к 1 л раствора, определим массу 1 л раствора:
=54 г/моль. Поскольку молярная и эквивалентная концентрации относятся к 1 л раствора, определим массу 1 л раствора:
mв=V*p=1102*10-3=1,102 кг в этом растворе содержится 1,102*0,1=0,1102 кг Na2CO3, или 110,2г что составляет: См=110,2/106=104 моль/л, Сн=110,2/53=2,08н
Пример5. Для нейтрализации 50 мл раствора серной кислоты израсходовано 25 мл 0,4 н раствора щелочи. Определите эквивалентную концентрацию раствора серной кислоты.
 Решение: Из закона эквивалентов следует:
Решение: Из закона эквивалентов следует:

 Отсюда
Отсюда  0,2 эквивалента в 1 л раствора.
0,2 эквивалента в 1 л раствора.
Поиск по сайту: