 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Скорость химической реакции прямо пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов
Для химической реакции
mA+nB=D
V=K[A]m[B]n (основное кинетическое уравнение)
Где [A] и [B] – концентрация веществ
m и n – стехиометрические коэффициенты
К – константа скорости.
Зависимость скорости химической реакции от температуры определяется правилом Вант – Гоффа, которое гласит:
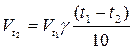 При повышении температуры на 100С скорость реакции возрастает в 2-4 раза.
При повышении температуры на 100С скорость реакции возрастает в 2-4 раза.
Vt1 – скорость химической реакции до изменения температур
Vt2 - скорость химической реакции после изменения температур
t1 t2 – температура
-  температурный коэффициент.
температурный коэффициент.
В зависимости от природы реагентов и условий протекания химического процесса различают:
необратимые
KClO3®KCl+O2↑
и обратимые реакции
NH4Cl↔NH3+HCl
В обратимых реакциях наступает момент, когда скорость прямой реакции становится равна скорости обратной реакции, то есть
K1[NH4Cl]=K2[NH3][HCl] такое состояние системы называют химическим равновесием.
При постоянной температуре отношения скоростей прямой и обратной реакции представляют собой постоянную величину, называемую константой равновесия.
Для обратимой реакции при данной температуре, отношение произведения равновесных концентраций продуктов реакций к произведению концентраций исходных веществ, возведенных в степень их стехиометрических коэффициентов, есть величина постоянная, называемая константой равновесия.
Для реакции аА+вВ«сС+дД
 | |||
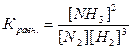 |
N2+3H2®2NH3
[NH3], [N2], [H2] – равновесные концентрации
7.2.При изменении внешних условий (температуры, давления, концентрации) нарушается равновесие, называемое смещением или сдвигом равновесия.
Направление, в котором происходит смещение, определяется принципом Ле – Шателье.
Поиск по сайту: