 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Решить задачи
41. При 17 0С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество при 1000С, если давление его останется неизменным?
42. При 27 0С и давлении 720 мм рт. ст. объем газа равен 5 л. Какой объем займет это же количество при 390С и давлении 104 кПа?
43. При 7 0С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до -330С?
44. Давление газа в закрытом сосуде при 120С равно 100 кПа (750 мм рт. ст). Каким станет давление газа, если нагреть сосуд до 300С?
45. Температура азот, находящегося в стальном баллоне под давлением 12,5 МПа, равна 170С. Предельное давление для баллона 20,3 МПа. При какой температуре давление азота достигнет предельного значения?
46. При давлении 98,7 кПа и температуре 910С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
47. Вычислить массу 2 л H2 при 150С и давлении 100,7 кПа (755 мм рт. ст.)
48. Вычислить массу 1 м3 N2 при 100С и давлении 102,9 кПа (772 мм рт ст.)
49. Вычислить массу 0,5 м3 Cl2 при 20 0С и давлении 99,9 кПа (749,3 мм рт ст)
50. Бертолетова соль при нагревании разлагается с образованием KCl и O2. Сколько литров кислорода при 00С и давлении 101,3 кПа можно получить из 1 моль KClO3?
51. Сколько моль содержится в 1 м3 любого газа при нормальных условиях?
52. Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
53. Какой объем при нормальных условиях занимают 27*1021 молекул газа?
54. Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание CO2 cоставляет 0,03% (условия нормальные).
55. Какой объем Н2 (при 170С и давлении 102,4 кПа) выделится при растворении 1,5г цинка в соляной кислоте?
56. Какой объем углекислого газа получится при сгорании 2л бутана? Объемы обоих газов измерены при одинаковых условиях.
57. Плотность этилена по кислороду равна 0,875. Определить молекулярную массу газа.
58. При некоторой температуре плотность паров серы по азоту равна 9,14. Из скольких атомов состоит молекула серы при этой температуре?
59. Вычислить молекулярную массу ацетона, если масса 500мл его паров при 870С и давлении 96 кПа (720 мм рт ст) равна 0,93г.
60.Масса 200 мл ацетилена при нормальных условиях равна 0,232г. Определить молярную массу ацетилена.
4. ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ.
4.1. Закон эквивалентов. Отношение масс (или объёмов) взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным массам (объёмам). Математически это можно записать следующим образом:
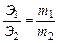 , где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
, где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
Под эквивалентом элемента понимают такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой. Эквивалент водорода ЭН всегда равен 1, а эквивалент кислорода ЭО=8.
Эквивалент элемента равен: Эм= 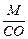 , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
, где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
Эквивалент оксида равен: Эм= 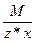 , где: М – мольная масса оксида; z – валентность кислорода; х – количество атомов кислорода в соединении.
, где: М – мольная масса оксида; z – валентность кислорода; х – количество атомов кислорода в соединении.
Эквивалент кислоты равен: Эм= 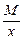 , где: М – мольная масса кислоты; х – основность кислоты (количество атомов водорода в кислоте)
, где: М – мольная масса кислоты; х – основность кислоты (количество атомов водорода в кислоте)
Эквивалент основания равен: Эм= 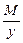 , где: М – мольная масса основания; у – кислотность основания (количество гидроксогрупп)
, где: М – мольная масса основания; у – кислотность основания (количество гидроксогрупп)
Эквивалент соли равен: Эм= 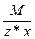 , где: М – мольная масса соли; z – валентность кислотного остатка; х – количество кислотных остатков в соединении.
, где: М – мольная масса соли; z – валентность кислотного остатка; х – количество кислотных остатков в соединении.
Примеры: эквивалент кислорода равен: Эо= 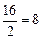 г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3=
г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3= 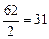 г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=
г-экв; эквивалент едкого натра NaOH равен: ЭNaOH= 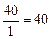 г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=
г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2= 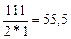 г-экв.
г-экв.
Поиск по сайту: