 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Физико-химические свойства белков
Находящиеся на поверхности белковой молекулы радикалы аспарагиной, глутаминовой кислот, тирозина и цистина, диссоциируя на ион водорода, придают ей отрицательный заряд. Радикалы лизина, аргинина и гистидина, диссоциирующие на ион гидроксила, наоборот придают молекуле белка положительный заряд. У большинства белков отрицательных зарядов на молекуле больше. Благодаря заряду они отталкиваются друг от друга и не слипаются в конгломераты. Слипанию препятствует также наличие вокруг молекулы белка водной оболочки.
В слабокислой среде тормозится диссоциация части отрицательно заряженных радикалов аминокислот, количество положительных и отрицательных зарядов сравнивается, молекулы белков становятся электронейтральными и слипаются в конгломераты и выпадабт в осадок. Слипанию их способствует и нагревание, приводящее к потере водной оболочки. Значение рН, при котором молекула белка становится электронейтральной, называется изоэлектрической точкой белка.
Классификация белков. Белки делятся на простые, состоящие только из аминокислот (альбумины, глобулины, проламины, глютелины, протамины, гистоны и пртеиноиды) и сложные, состоящие из белковой и небелковой части. У хромопротеинов небелковой частью может быть окрашенное вещество (например гем у гемоглобина), у липопротеинов - липидная часть, у гликопротеинов - гетерополисахарид, у фосфопротеинов - фосфорная кислота, у нуклеопротеинов - ДНК или РНК. Нуклеиновые кислоты состоят из нуклеотидов. Последние состоят из азотистого основания, пуринового (аденин и гуанин) или пиримидинового [цитозин, тимин (у ДНК) или урацил (у РНК)], дезоксирибозы (у ДНК) или рибозы (у РНК) и фосфорной кислоты. Сборка нуклеотида из аденина, дезоксирибозы и фосфорной кислоы показана ниже.

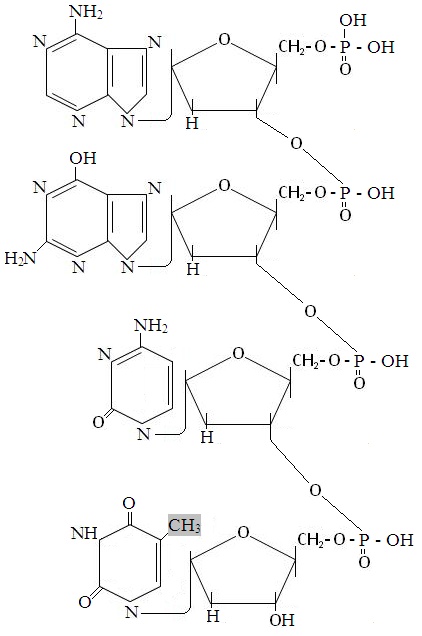
Молекула ДНК состоит из четырех разновидностей нуклеотидов6 дезоксиаденозинмонофосфата (дАМФ), дезоксигуанозинмонофосфата (дГМФ), дезоксицитидинмонофосфата (дЦМФ) и дезокситимидинмонофосфата (дТМФ). Нуклеотиды связаны между собой посредством фосфодиэфирной связи межде вторым углеродным атомом дезоксирибозы и фосфорной кислотой соседнего нуклеотида, как показано в фформуле фрагмента ДНК, состоящего из дАМФ, дГМФ, дЦМФ и дТМФ.
Структура и биологическая роль углеводов.
Углеводы – полиоксикарбонильные соединения, являющиеся по своей природе альдо- или кетоспиртами или их производными. По химической структуре различают: 1) моносахариды (рибоза, дезоксирибоза, глюкоза, галактоза, фруктоза и др.); 2) олигосхариды (сахароза, мальтоза, лактоза и др.); 3) гомопосахариды (гликоген, крахмал, клетчатка и др.) и гетероплсахариды (гиалуроновая, хондроитинсерная кислоты, кератансульфат и др.).
1. Моносахариды.

Превращение Д-дезоксирибозы в α-Д-дезоксирибофуранозу.
Превращение Д-глюкозы в α-Д-глюкопиранозу 
Превращение Д-глюкозы в α-Д-глюкопиранозу

Превращение Д-глюкозы в β-Д-глюкопиранозу

Превращение Д-глюкозы в β-Д-глюкопиранозу

Превращение Д-фруктозыозы в β-Д-фруктофуранозу
2. Олигисахариды

Мальтоза
Лактоза 

Сахароза.
3. Гомоолисахариды

Клетчатка, состоящая из остатков β-Д-глюкопиранозы.

Крахмал, состоящий из остатков α-Д-глюкопиранозы.


Гиалуроновая и хондроитинсерная кислоты, компоненты гетерополисахаридов.
Поиск по сайту: