 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глюкурониды участвуют в детоксикации
|
Читайте также: |
Специфические функции углеводов. входят в состав групповых факторов крови, гепарин, антигены в мембранах при развитии клеточного иммунитета.Углеводы – связующее звено между солнцем, растениями, животными, человеком. В растениях содержится глюкоза,
при распаде которой в организме человека освобождается энергия.
Углеводы поступают в организм человека с хлебом, растительной пищей.
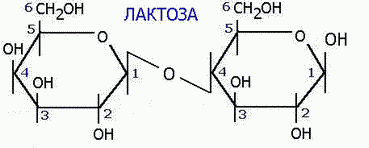
Основные углеводы пищи: глюкоза, лактоза, сахароза, крахмал, гликоген, клетчатка.
Переваривание углеводов Ферменты, расщепляющие углеводы, относятся к гидролазам, так как осуществляют гидролиз гликозидных связей.
Переваривание начинается в ротовой полости. а-Амилаза слюны расщепляет а-1,4-гликозидные связи, не гидролизует связи в дисахаридах. Оптимум рН амилазы – 6,8.
Крахмал расщепляется до декстринов и небольшого количества мальтозы.
Кислый желудочный сок прекращает действие амилазы, лишь в глубине желудка идёт переваривание углеводов до мальтозы.
Переваривание углеводов в кишечнике В двенадцатиперстной кишке а-амилаза панкреатическая(рН =7,5-8,0) завершает переваривание крахмала и гликогена до мальтозы.
В кишечном соке мальтаза, сахараза, лактазаосуществляют гидролиз дисахаридов на поверхности клеток и внутри энтероцитов у взрослых.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу. Этот комплекс присоединяется к мембране микроворсинок кишечника. Расщепляет а-1,4- и а-1,6- гликозидные связи. Гликоамилазный комплекс (действует как мальтаза) гидролизует а-1,4- гликозидные связи в олигосахаридах

Лактаза кишечного сока гидролизует в-1,4 -гликозидные связи между галактозой и глюкозой в лактозе.
Механизм трансмембранного переноса глюкозы Глюкоза и фруктоза всасываются из кишечника в клетки слизистой оболочки путём облегчённой диффузии с помощью специфических белков – переносчиков.
Глюкоза и галактоза переносятся в энтероциты путём активного транспорта, зависимого от градиента концентрации ионов натрия.
Из клеток кишечника в кровь глюкоза поступает в кровь с помощью облегчённой диффузии. Из кровотока потребление глюкозы клетками осуществляется путём облегчённой диффузии при участии специальных белков – транспортеров.
Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином. Без инсулина мембрана этих клеток непроницаема для глюкозы, так как в ней нет белков-переносчиков для глюкозы.
В клетки печени глюкоза проходит при участии белка
глют-2, независимо от инсулина.
Бифидобактерии анаэробные молочнокислые бактерии, населяющие кишечник человека, составляют 95-98% всей микрофлоры кишечника, обнаруживаются уже на 3-5 день после рождения. ферментируют углеводы с образованием молочной и уксусной кислот, тем самым способствуя всасыванию углеводов, способствуют синтезу витаминов К и В1, непатогенны для человека. Антагонисты энтеропатогенных и гнилостных бактерий.
Мальабсорбция дисахаридов -нарушения всасывания, вызванные расстройствами транспортных механизмов и недостаточностью пищеварительных ферментов.
Различают: синдром первичной мальабсорбции (наследственный),синдром вторичной мальабсорбции.
Этиология: снижение активности ферментов расщепления углеводов и транспортных переносчиков через кишечную стенку,недостаточное поступление в кишечник ферментов с пищеварительными соками,инактивирование ферментов,морфологические изменения тонкой кишки и нарушение перистальтики.
Непереносимость лактозы Первичная непереносимость лактозы
Недостаточность лактазы наследуется по аутосомно-рецессивному типу.
Лечение: маленьким детям в молоко добавляют лактазу. Приобретённая непереносимость лактозы наблюдается при энтероколитах, язвенных колитах.
Симптомы: метеоризм, диарея при употреблении молока. У взрослых чаще бывает приобретённая непереносимость глюкозы. При непереносимости лактозы наблюдается лактозурия.
3.О поражении какой ткани можно думать, если в крови больного повышена активность АЛТ, ЛДГ и аргиназы? За счет каких изоферментов ЛДГ можно предполагать повышение активности фермента?
Билет 31 печень, ЛДГ 5
Билет 32.
Химическая природа ферментов. Активный и аллостерический центры, их роль.
Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью.
Ферменты могут быть простыми белками пепсин, трипсин, уреаза, лизоцим.
Ферменты могут быть сложными белками ЛДГ, трансаминазы.
Сложные ферменты помимо белковой части содержатнебелковую часть – кофермент.
Ферменты, являясь белками, имеют каждый свою I, II, III, IV – структуры. Активный центр фермента это зона молекулы фермента, которая отвечает за выбор субстрата, связывание и превращение его в продукты реакции. Активный центр формируется в процессе образования III и IV структуры фермента. Он выполняет каталитическую функцию. Его формируют чаще следующие аминокислоты: серин, цистеин, лизин, гистидин, глутаминовая кислота, аспарагиновая кислота, тирозин, которые имеют функциональные группы в радикалах. Эти группы в ходе катализа реагируют с субстратом. Субстрат – это вещество, на которое действует фермент, в результате чего образуются продукты реакции. В активном центре рассматривают каталитический и субстратный участки. В субстратном участке фиксируется субстрат, а в каталитическом – происходит превращение субстрата, при условии, если есть стерическое соответствие субстрата и активного центра фермента.
Аллостерический центр характерен для ферментов, имеющих IV-структуру. Это другой центр, пространственно не совпадает с активным центром. С этим центром связываются определённые, обычно низкомолекулярные, вещества (эффектроы или модуляторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет III и IV- структуры молекулы фермента и соответственно конфигурацию активного центра, вызывая либо снижение или повышение активности фермента.
Апотомический путь обмена глюкозы. Окислительная и неокислительные ветви процесса. Биологическое значение пентозного цикла.
ПЕНТОЗНЫЙ ЦИКЛ апотомический (усечённый) С6 вС5 + СО2,
прямое окисление глюкозы, добавочный метаболический путь, идёт в определённых тканях: печени, жировой ткани, хрусталике, роговице, эритроцитах, половых железах, надпочечниках, молочных железах.
В цитоплазме клеток в цикл вступают сразу не менее 6 молекул глюкозы.
Поиск по сайту: