 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глюкозо-6-фосфатдегидрогеназы
Эритроциты нестойкие. Происходит гемолиз. Развивается анемия. Пентозный цикл в эритроцитах поставляет
НАДФН+Н для восстановления окисленного глутатиона.
2 Глутатион-SH + Н2О2 в Г-S-S-Г + 2Н2О.
Накопление перекиси сокращает время жизни эритроцита.
При недостатке витамина В1 Нарушается пентозный цикл. Определение активности транскетолазы крови позволяет судить о степени недостаточности тиамина. При перницитозной анемии возрастает активность транскетолаз. Нарушаются процессы синтеза нуклеиновых кислот, жирных кислот.
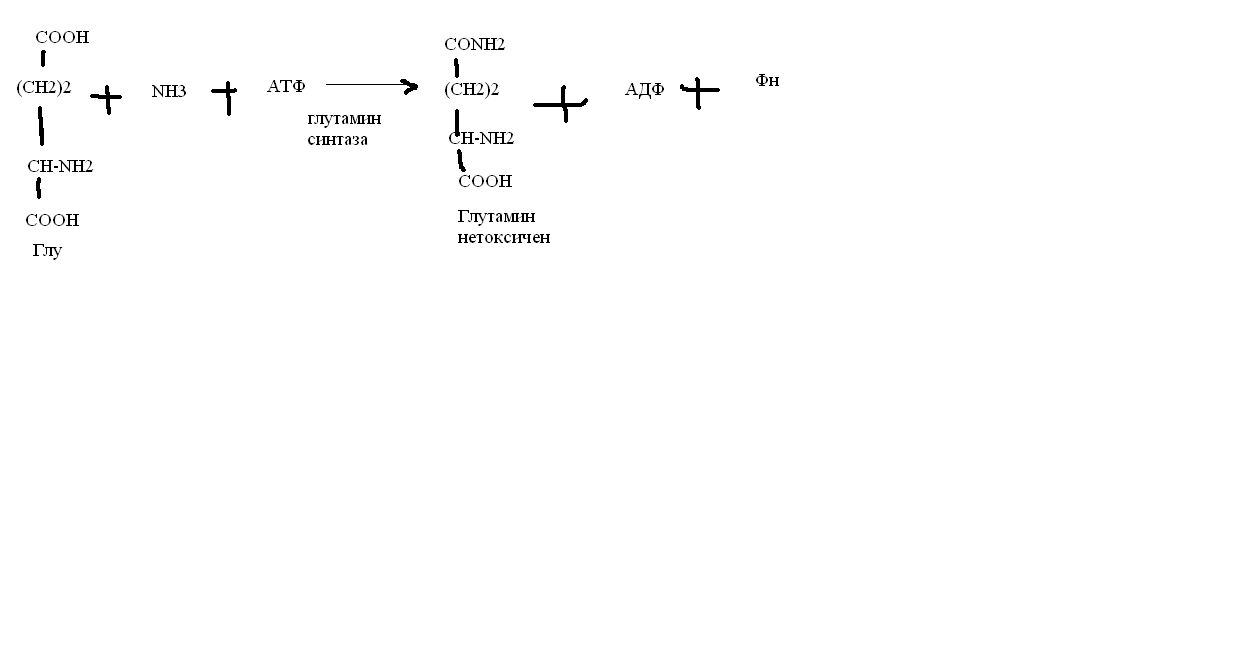
3.Аммиак является раздражителем нервной системы. При введении глутаминовой кислоты больным эпилепсии их состояние улучшается: частота приступов, судорог снижается. Почему? Напишите, какие биохимические реакции происходят в мозгу при введении глутаминовой кислоты?
Билет 32 связывает белок
Предшественник. ГАМК-тормозн медиатор
Билет 33.
1)Основные функции белков в организме. Структурная организация белковой молекулы. Особенности формирования первичной, вторичной, третичной и четвертичной структур белка.
Функции белков структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, опорная, обезвреживающая, энергетическая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение.
Первичная структура белка порядок, последовательность расположения АМК в полипептидной цепи.
Свойства первичной структуры белка уникальна, детерминирована генетически, её стабильность обеспечивается в основном пептидными связями, возможно участие небольшого числа дисульфидных связей, в первичной структуре детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, в полипептидной цепи могут быть обнаружены разнообразные комбинации АМК: не во всех белках содержатся все 20 АМК, ни в одном белке АМК не содержатся в эквивалентных отношениях, некоторые АМК встречаются редко и в меньшем количестве (гли в 10 раз чаще, чем три). принцип структурного подобия (в белках встречаются идентичные пептидные структуры), в состав полипептидной цепи входит 100-1000 АМК. Даже небольшие изменения первичной структуры изменяют свойства белков. HbA1 - у здоровых людей, HbS - у больных серповидно-клеточной анемией.
HbS в шестом положении β-цепи вместо глу имеет валин.Отличается по физическим, химическим и биологическим свойствам.
Вторичная структура пространственное расположение полипептидной цепи, поддерживаемое водородными связями С=О … Н-N между фрагментами цепи. Связи нековалентные, непрочные.
α-спираль устойчивая винтовая лестница, закрученная по часовой стрелке,NН-группа остатка АМК взаимодействует с СО – группой четвёртого от него остатка, на виток приходится,6 АМК остатка, 5,4 Å – шаг спирали (расстояние между витками).
АМК формирующие α-спираль: ала, лей, глн, цис, фен, тир, три, мет, вал,
дестабилизирующие α-спираль: сер, иле, тре, глу, лиз, арг, гли, асп,
нарушающие α-спираль: про, оксипролин. Белки с α-спиралью: гемоглобин, миоглобин.
β-складчатость пептидные цепи располагаются параллельно друг другу в один слой, подобно листу, сложенному гармошкой.
На каждой плоскости образуются пептидные связи и радикалы выходят из структуры.Полипептидные цепи могут формировать параллельные ли антипараллельные β-структуры.
Складчатые структуры В белках встречаются области с нерегулярной вторичной структурой, которые называются беспорядочными клубками. Во многих белках присутствует и α-спираль и β-складчатость. Белки с β-складчатостью β-кератины (фиброин шёлка), фибриллярные белки волос, шёлка.
Третичная структура пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями.Все биологические свойства белков связаны с сохранностью их третичной структуры.
Связи дисульфидная – ковалентная,
Все остальные связи нековалентны: гидрофобные – между аминогруппами с неполярными радикалами (вал, мет, ала, фен, иле), водородные между полярными радикалами (OH, NH2, SH, COOH), ионные - между заряженными полярными радикалами (лиз, арг, гис, асп, глу).
Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром.
Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование.
Четвертичная структура белок может состоять из нескольких цепей, число и взаиморасположение в пространстве которых различно.
Олигомерные белки состоят из нескольких полипептидных цепей: гемоглобин -4, гексокиназа – 2, ГЛДГ -6, ферритин -24.
Связи, поддерживающие четвертичную структуру гидрофобные, ионные, водородные.
Белки с известной четвертичной структурой гемоглобин, ГЛДГ, миоглобин, ГК.
2.Образование и распад ацетоновых тел. Кетогенез в норме и при патологии.
Кетоновые тела образуются из ацетил-КоА, синтезируются в печени. Содержание кетоновых тел в крови здоровых людей: 0,8 – 1,2 ммоль/л.
Поиск по сайту: