 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Ответ. Поражение тканей печени. За счет изофермента ЛДГ 4 и 5
Билет 32.
Химическая природа ферментов. Активный и аллостерический центры, их роль.
Апотомический путь обмена глюкозы. Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
Аммиак является раздражителем нервной системы. При введении глутаминовой кислоты больным эпилепсией их состояние улучшается: частота приступов, судорог снижается. Почему? Напишите, какие биохимические реакции происходят в мозгу при введении глутаминовой кислоты?
1. Структура и общие свойства ферментов.
Энзимология – наука о ферментах. Фермент – биологический катализатор белковой природы. Энзимология появилась на стыке химической, биологической и медицинской наук.
Значение ферментов - любые химические превращения веществ в организме происходят при участии ферментов, практическое применение ферментов во всех областях деятельности, где речь идёт о живых существах: хлебопечение, виноделие, сыроварение, чайное, кожевенное, меховое производство.
В настоящее время известно 10 000 ферментов, 500 получено в кристаллическом состоянии.
Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью.
Ферменты могут быть простыми белками - пепсин, трипсин, уреаза, лизоцим. Ферменты могут быть сложными белками - ЛДГ, трансаминазы. Сложные ферменты помимо белковой части содержат небелковую часть – кофермент. Субстрат – вещество, на которое действует фермент и которое им активируется.
Активный центр фермента – несколько аминокислотных остатков, которые в ходе ферментативного катализа взаимодействуют с субстратом. У сложных ферментов в активный центр входят и простетические группы (коферменты). Для формирования активного центра имеют значение третичная и четвертичная структуры фермента, так как в активный центр входят аминокислоты, расположенные далеко друг от друга. Наиболее часто в активный центр входят 3-5 аминокислот.
Часто встречаются в активном центре гис, лиз, арг, асп, глу, сер, тир, цис.
Для проявления активности фермента необходимо наличие функциональных групп.
Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры.
Отличия ферментов от неорганических катализаторов - высокая молекулярная активность, лабильность - ферменты действуют при относительно мягких условиях (t, рН, давление), специфичность действия, регуляция ферментов нейрогуморальным путём с участием других ферментов. Структура активного центра фермента комплементарна структуре его субстрата.
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзимати-ческой активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента. Получены доказательства, что для субстрата аллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов, – гетеротропными взаимодействиями.
2. Апотомический распад глюкозы иначе называется пентозофосфатным циклом. В результате протекания этого пути из 6 молекул глюкозо-6-фосфата распадается одна. Апотомический распад можно разделить на две фазы: окислительную и анаэробную. Рассмотрим отдельные реакции этого метаболического пути.
Окислительная фаза апотомического распада глюкозы. Как и в гликолизе первой стадией является фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Далее глюкозо-6-фосфат дегидрируется с участием глюкозо-6-фосфатдегидрогеназы, коферментом которой служит НАДФ. Образующийся 6-фосфоглюконолактон спонтанно или с участием лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты. Заключительным процессом окислительной ветви пентозофосфатного цикла является окисление 6-фосфоглюконовой кислоты соответствующей дегидрогеназой. Одновременно с процессом дегидрирования происходит декарбоксилирование 6-фосфоглюконовой кислоты. С потерей одного углеродного атома глюкоза превращается в пентозу:

Анаэробная фаза апотомического распада глюкозы.Рибулозо-5-фосфат, образовавшийся в окислительной фазе, может обратимо изомеризоваться в другие пентозофосфаты: ксилулозо-5-фосфат и рибозо-5-фосфат. Катализируют эти реакции два разных фермента, относящиеся к классу изомераз: пентозофосфат изомераза и пентозофосфат эпимераза. Образование из рибулозо-5-фосфата двух других пентозофосфатов необходимо для осуществления последующих реакций пентозофосфатного цикла, причем требуется две молекулы ксилулозо-5-фосфата и одна молекула рибозо-5-фосфата. 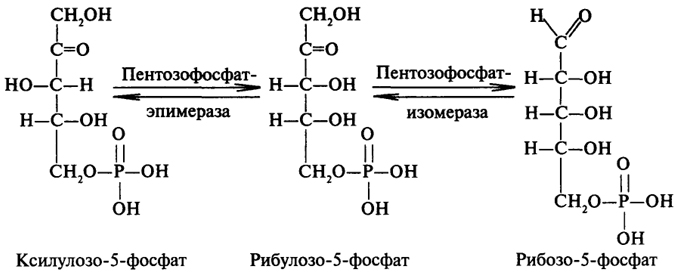
Далее идут реакции с участием ферментов трансфераз, переносящих молекулярные остатки - трансальдолазы и транскетолазы.
3. Гамма-аминомасляная кислота в организме образуется из другой аминокислоты -- глутаминовой -- в реакции декарбоксилирования. Гамма-аминомасляная кислота синтезируется только в нервной системе при посредстве глутаматдекарбоксилазы: HOOC-CH2-CH2-CH(NH2)-COOH→ HOOC-CH2-CH2-CH2-NH2 + СО2
Глутаминовая кислота ГАМК
Цикл превращений в мозге включает такие сопряженные ферментативные реакции, как декарбоксилирование глутамата с образованием ГАМК под действием глутаматдекарбоксилазы, так и переаминирование ГАМК ГАМК-трансаминазой в глутамат с образованием янтарного полуальдегида.
HOOC-CH2-CH2-CH2-NH2 →HOOC-CH2-CH2-CH(O)
ГАМК Янтарный полуальдегид.
Гамма-аминомасляная кислота является основным ингибиторным трансмиттером (передатчиком) в ЦНС. Она осуществляет нейрональную трансмиссию в 1/3 всех синапсов головного и спинного мозга. ГАМК играет важную роль в регуляции двигательных функций. При этом особенностью нейротрансмиттерной организации супраспинальных двигательных центров (в первую очередь базальных ганглиев и коры мозжечка) является большое количество ГАМК-ергических нейронов, оказывающих тормозное влияние на активность спинальных интер- и мотонейронов через ингибиторные ГАМК-ергические системы, которые, переключаясь в зрительном бугре, церебральной коре и/или двигательных ядрах мезодиэнцефальной области и мозгового ствола, идут в составе руброспинального, вестибулоспинального и ретикулоспинального трактов. В спинном мозге ГАМК выполняет функции ингибиторного трансмиттера как на пресинаптических рецепторах, локализованных на терминалях афферентных проекций, так и на постсинаптических рецепторах мотонейронов и интернейронов.
Билет 33.
Поиск по сайту: