 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Как осуществляется связывание аммиака в различных тканях человеческого организма и его выделение? Напишите уравнения соответствующих реакций
1. Специфичность действия ферментов.
Каждый фермент действует строго на одно вещество или очень небольшое число близкородственных веществ. Если бы ферменты не обладали специфичностью, их действие приводило бы к распаду клеточного материала. Структура активного центра фермента комплементарна структуре его субстрата.
Специфичность действия ферментов. Абсолютная специфичность - Фермент катализирует превращение только одного субстрата. Уреаза, аргиназа.
Стереоспецифичность - фермент катализирует превращение одного из стереоизомеров, оксидазы L и D аминокислот.
Относительная специфичность - Фермент действует на субстраты разных групп химических соединений.
Специфичность по типу реакции. Цитохром Р450.
Групповая специфичность - Фермент действует на отдельные связи определённой группы субстратов. Пепсин расщепляет связи, образованные аминогруппой тирозина или фенилаланина. Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы лиз и арг. Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК. Эластаза гидролизует пептидные связи, в образовании которых участвуют СООН-группы гли, ала.
Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры.
Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:

Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса и соответственно на фермент E1.
Типы ингибирования. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую.
2. Тироксин. Гормон щитовидной железы, производное тирозина, йодсодержащий гормон. На долю тироксина приходится ¾ всего йода, содержащегося в крови.
Этапы синтеза тироксина
1. Окисление йода катализирует фермент – тиреопероксидаза. Щитовидная железа – единственная ткань, способная окислять йод до состояния с более высокой валентностью, что необходимо для синтеза тиреоидных гормонов.
2. Окисленный йод внедряется в тиреоглобулин. Происходит йодирование тирозина в составе тиреоглобулина. Образуются МИТ и ДИТ.
3. Конденсация йодтирозинов
Тиреоглобулин – большой йодированный белок. 70% йодида в этом белке находится в составе неактивных предшественников МИТ и ДИТ. 30% - в виде Т3 и Т4. Тиреоглобулин – форма хранения Т3 и Т4 в коллоиде, обеспечивает поступление этих гормонов в кровь.
Синтез тиреоглобулина: контролируется по цепочке: тиролиберин ТТГ синтез тиреоглобулина ограничивается:
1) тиреоидными гормонами, которые подавляют секрецию тиролиберина,
2) протеиназами плазмы, которые расщепляют тиролиберин во время его транспорта кровью.
4. Тироксин выделяется в кровь после гидролиза тиреоглобулина протеазами лизосом фолликулярных клеток щитовидной железы.
Тироксинсвязывающий белок преальбумин и альбумин транспортируют Т4. Концентрация тироксина контролируется ТТГ. При недостатке йода могут образоваться моно- и дииодтиронины. Распад Т3 и Т4 происходит в клетках печени.
Механизм действия тироксина. Тироксин легко проходит через клеточную мембрану. Внутри клетки имеет рецепторы в: ядре, митохондриях, цитоплазме.
Действие тироксина. Тироксин активирует аденилатциклазу в чувствительных к нему тканях: печень, почки, сердце, жировая ткань, скелетные мышцы. Тироксин действует на все ткани и обмены. Он необходим для нормального роста, развития, дифференцировки тканей. Тироксин вначале стимулирует энергопотребляющую систему (активный мембранный перенос ионов натрия). За этим следует поглощение кислорода тканями, усиление синтеза белка, необходимое для образования митохондрий, а затем наполнение их ферментами. Тироксин – анаболик в малых дозах в детстве. В больших дозах во взрослом организме тироксин – катаболик: стимулирует распад белков, липидов, активирует глюконеогенез.
Действие тироксина - увеличивает скорость основного обмена, усиливает поглощение кислорода тканями, обеспечивает теплопродукцию, стимулирует синтез белков, ускоряет синтез многих ферментов, повышает активность ферментов, стимулирует сердечную деятельность, стимулирует проведение нервных импульсов, увеличивает всасывание глюкозы, стимулирует трансляцию и транскрипцию, тормозит синтез жира из глюкозы, стимулирует липолиз.
Функция щитовидной железы в норме и патологии. Щитовидная железа развивается на 3 неделе внутриутробного развития. На 12 неделе железа способна синтезировать гормон. У новорожденных отмечена гиперфункция щитовидной железы. К 5 – 10 годам железа функционирует как у взрослых.
При недостатке тироксина возникает: кретинизм в детстве, микседема у взрослых.
Кретинизм - врождённое нарушение синтеза тироксина. Клинические проявления: остановка роста, изменения кожи, волос, мышц, нарушения психики.
Микседема – слизистый отёк. Чаще встречается у женщин. Клинические проявления: нарушение водно-солевого, основного, жирового обменов, патологическое ожирение, выпадение волос и зубов, психические расстройства, вялость, отёчность, снижение интенсивности окислительно-восстановительных процессов.
Эндемический зоб обусловлен недостатком йода в питьевой воде, почве и растениях определённых районов земного шара. При заболевании компенсаторно разрастается соединительная ткань. Наблюдается ухудшение интеллектуального, полового, физического развития детей. В регионах тяжёлой зобной эндемии распространён врождённый гипотиреоз, дети с эндемическим неврологическим кретинизмом, глухонемота, резкое снижение интеллекта, спастическая диплегия. В регионах средней степени эндемии – тугоухость, нарушения речи, лёгкие моторные нарушения.
Заболевания (состояния), ассоциированные с зобной эндемией - Снижение интеллектуального потенциала населения. Бесплодие, невынашивание беременности, высокая перинатальная и младенческая смертность ® демографические проблемы. Ухудшение состояния здоровья населения: - высокий уровень заболеваемости - высокий уровень хронических заболеваний - акселерация атеросклероза - рост кардиоваскулярных заболеваний - йоддефицитный эндемический зоб - смешанного генеза.
Ранняя диагностика врождённого гипотиреоза осуществляется путём определения ТТГ в капиллярной крови новорожденных на 4-5 день жизни. О наличии в регионе йодной недостаточности свидетельствует большая частота показателей ТТГ выше 5 м Ед/л. Степень экологической напряжённости влияет на тиреоидную функцию новорожденных. Явное снижение функции щитовидной железы при гипотиреозе и скрытое при йоддефицитном зобе оказывает неблагоприятное воздействие на состояние репродуктивной системы женщины, снижая адаптационные резервы и обуславливая развитие иммунодефицитных состояний.
Тиреотоксикоз обусловлен повышенным содержанием в крови гормонов щитовидной железы. Тироксин разобщает тканевое дыхание и окислительное фосфорилирование, снижается концентрация АТФ, идёт распад белков, жиров, углеводов.
Клинические проявления: худоба, тахикардия, экзофтальм, остеопороз, раздражительность, психические расстройства, нарушение сна, потливость, повышение температуры тела, астения, снижение психической активности.
3. Ответ.
Пути обезвреживания аммиака –
синтез мочевины (печень)  ,
,
образование амидов АМК (кл. мозга) 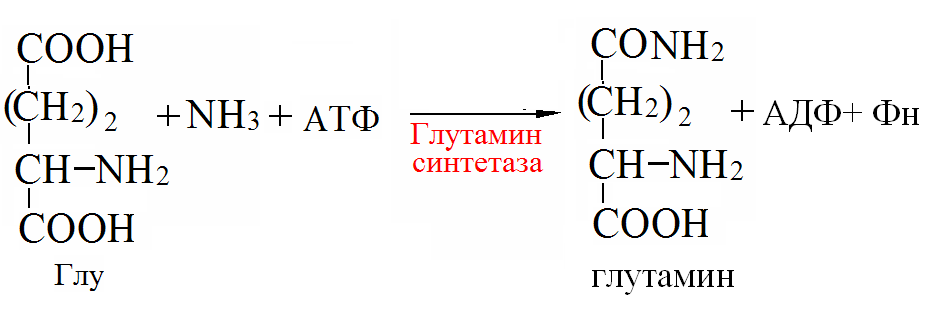 ,
,
восстановительное аминирование (в регенерирующей печени)  ,
,
образование аммонийных солей (почки)  →
→ 
Билет 39.
Поиск по сайту: