 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Недостаточность Г-6-ФДГ в эритроцитах
Билет 1.
1. Мультиферментные комплексы и изоферменты. Клиническое значение определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
Изоферменты - множественные молекулярные формы фермента данной особи, катализирующие одну и ту же реакцию, но разделяющиеся при помощи физико-химических методов, так как отличаются по физико-химическим свойствам:
l электрофоретические свойства, адсорбционные свойства, оптимум рН, термостабильность, чувствительность к ингибиторам, сродство к субстрату, небольшие различи в первичной структуре.
Генетически детерминированные изоферменты возникают в результате множественности аллелей в одном локусе.
Посттрансляционные (вторичные) изоферменты возникают в результате химической модификации исходного фермента или его частичного протеолиза.
Применение изоферментов
l С помощью изоферментного анализа удаётся выявить небольшие мутации.
l Изоферменты изменяются в процессе развития и дифференцировки (в печени эмбриона – ГК1, а в печени взрослого – ГК3 и ГК4).
l Изоферменты играют роль в регуляции метаболизма.
Определение изоферментов сыворотке крови для диагностики
l При инфаркте миокарда в крови повышается активность ЛДГ1 и ЛДГ2, а при патологии печени – ЛДГ5 и ЛДГ4.
l В опухолевых тканях повышается ЛДГ5 и уменьшается ЛДГ1, возможен эмбриональный изоферментный спектр.
l При детском церебральном параличе повышается ЛДГ5 и ЛДГ4, уменьшается ЛДГ1, ЛДГ2, МДГ1, МДГ2, повышается МДГ4.
Мультиферментные комплексы
l Чаще ферменты построены из двух или более полипептидов, каждый из которых уложен в отдельную глобулу.
l ряд ферментов многоэтапного биохимического процесса: действие одного фермента – необходимый этап для действия другого.
l Продукт действия одного фермента становится субстратом для следующего.
К ним относятся:
l синтетаза жирных кислот, пируватДГ комплекс, дыхательная цепь, ферменты гликолиза.
2. Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жирных кислот с нечетным количеством углеродных атомов и ненасыщенных жирных кислот.
ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
-аэробный процесс.
-В катаболизме жирных кислот выделяют 3 части:
1.β-окисление,2.ЦТК,3.дыхательная цепь.
Позвоночные половину энергии получают за счёт окисления жирных кислот, особенно в спячке и при голодании.Активация жирных кислот происходит на наружной поверхности мембраны митохондрий.
β-ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ в митохондриях включает стадии
-первая стадия дегидрирования,
-стадия гидратации,
-вторая стадия дегидрирования,
-тиолазная реакция.

Баланс β-окисления пальмитиновой кислоты (С16) При окислении жирной кислоты, содержащей n углеродных атомов:
•получается n/2ацетил-КоА,
•происходит (n/2 –1)циклов β-окисления, так как при окислении бутирил-КоА получаются сразу 2 молекулы ацетил-КоА.
Расчёт для пальмитиновой кислоты:
•16/2 = 8 ацетил-КоА,
•16/2 –1 = 7 циклов β-окисления,
•7*5 = 35
•8*12 = 96
•96 + 35-1=130 АТФ.
β-окисление ненасыщенных жирных кислот
•Наличие дополнительных ферментов изомеразы и эпимеразы обеспечивает возможность полного окисления всех ненасыщенных жирных кислот.
•Осуществляется:
•перемещение двойной связи из положения 3-4 в положение 2-3,
•изменение конфигурации двойной связи из цис-в транс-положение при помощи фермента цис-трансеноилКоА-изомеразы.
3. О каком заболевании следует думать, если моча новорожденного ребенка дает положительную реакцию на наличие фенилпирувата? Какой молекулярный блок лежит в основе данной патологии?
Билет1 олигофрения фенил ПВК
Билет2.
1. Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных реакций.
В основе классификации лежит тип катализируемой реакции.
•Оксидоредуктазыкатализируют окислительно-восстановительные реакции.
•Трансферазы-реакции с переносом групп.
•Гидролазы -гидролитический разрыв связи СС, СN, СSс присоединением воды по месту разрыва.
•Лиазы–реакции негидролитическогорасщепления с образованием двойных связей, некоторые обратные реакции синтеза.
•Изомеразы–перенос групп внутри молекулы с образованием изомеров.
•Лигазыкатализируют соединение двух молекул, сопряжённое с разрывом пирофосфатнойсвязи АТФ.
Примеры лиаз: •фумараза, •альдолаза, •дегидратаза, •цитратсинтаза.
· Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
2. Регуляция липидного обмена. Гормоны, влияющие на обмен липидов. Патология липидного обмена: гиперлипидемии, атеросклероз, липоидозы, жировое перерождение печени, ожирение.
Инсулин
•Усиливает поглощение глюкозы жировой тканью. Способствует образованию ацетилКоА.
•Активирует пентозный цикл (НАДФН2).
•Активирует ацетилКоАкарбоксилазу и синтетазу жирных кислот.
•Активирует синтез триглицеридов.
•Активирует фосфодиэстеразу (усиление гидролиза цАМФ), снижение активности аденилатциклазы.
•Повышает синтез ЛПНП и ЛПОНП.
•Тормозит освобождение жирных кислот из жировой ткани в результате активации гликолиза.
•В периферических тканях активирует липазу и липопротеидлипазу. Активирует утилизацию липидов тканями.
Роль инсулина в депонировании жира
Простагландины-производные ненасыщенных жирных кислот.
•угнетают мобилизацию жирных кислот из жировой ткани за счёт угнетения аденилатциклазы и ослабления действия катехоламинов на аденилатциклазу.
Пролактин
•у женщин в период лактации избыток пролактина приводит к переводу углеводов в жиры,
•НАДФН2 из пентозного цикла идёт на синтез жиров.
СТГ
•способствует мобилизации жира из жировой ткани,
•повышает содержание свободных жирных кислот в крови и их окисление в печени,
•усиливает синтез липазы и аденилатциклазы.
Глюкокортикоиды
•стимулируют липолиз в конечностях и липогенез в верхней части туловища (развивается ожирение по «буйволовому» типу),
•усиливают синтез жира в печени,
•усиливают липолитическое действие СТГ и адреналина,
•в крови повышают уровень свободных жирных кислот,
•стимулируют превращение жирных кислот в кетоновые тела,
•снижают потребление и использование глюкозы жировой тканью.
Тироксин
•стимулирует липолиз жирных кислот, •повышает сгорание жирных кислот,•способствует выделению холестерина,•усиливает окисление холестерина.
Нарушение транспорта жира кровью. Гиперлипидемия.
•Алиментарная гиперлипидемия •возникает через 2-3 часа после еды, максимума достигает через 4-6 часов, •через 9 часов возвращается к норме.
Ретенционная гиперлипидемия
•при атеросклерозе из-за уменьшения гепарина в крови снижается активность липопротеинлипазы, увеличивается содержание ТГ,•при нефрозе,•при сахарном диабете из-за дефицита липокаина, активирующего поступление в кровь липопротеинлипазы и из-за недостаточного поступления глюкозы в жировую ткань,•при застойной желтухе из-за появления в крови ингибиторов липопротеинлипазы –желчных кислот.
Транспортная гиперлипидемия
•развивается при усиленной мобилизации жира из жировой ткани, когда элиминация его из крови будет отставать от темпа поступления из депо.
•при стрессе, голодании гиперлипидемия сопровождается гиперхолестеринемией, способствует свёртыванию крови.
Липурия наблюдается при:
•переломе трубчатых костей,•травме жировой ткани,•липоидном нефрозе,•после приёма с пищей
больших количеств жира.
Гиперлипопротеинемии
I.Гиперхиломикронемия (экзогенная гиперлипидемия)-генетически обусловленная недостаточность липопротеинлипазы.
•в плазме много хиломикронов, триглицеридов,•ксантоматоз,•гепатоспленомегалия,•приступы кишечной колики,•кровь –«борщ со сметаной»,•риск атеросклероза малый,•проявляется в детстве.
IIа. Гиперхолестеринемия –наследственная гиперхолестеринемия,
•проявляется в детстве,•связана с недостаточностью рецепторов для ЛПНП,•в крови повышено содержание ЛПНП, холестерина,•риск атеросклероза высокий.
IIв. Комбинированная гиперлипидемия (повышено содержание ЛПНЛ, ЛПОНП),
•увеличены фракции липидов, холестерин, эндогенные триглицериды,
•риск атеросклероза высокий.
III. Диабетолипопротеинемия
•увеличен холестерин, эндогенные триглицериды,
•риск атеросклероза высокий,
•нарушено превращение ЛПОНП в ЛПНП и в крови появляются флотирующие ЛПОНП и ЛПНП (аномальные).
IV.Эндогенная гиперлипидемия
•увеличены ЛПОНП,•гипертриглицеридемия,•проявляется у взрослых,•сочетается с атеросклерозом, ожирением, сахарным диабетом.
V.Смешанная гиперлипидемия
•увеличены эндогенные и экзогенные триглицериды, хиломикроны, ЛПОНП,
•«жирная плазма»,•снижена активность липопротеинлипазы,
•у взрослых встречается редко, •риск атеросклероза малый.
Ожирение: •дисбаланс между липогенезом и липолизом, превалирует липогенез. Жиры образуются очень интенсивно из углеводов: дихотомический распад глюкозы поставляет ацетил-КоА и ДАГ. Пентозный цикл даёт НАДФН2. Различают: •алиментарное ожирение •ожирение, связанное с эндокринной патологией.
•Жировая ткань без глюкозы не обладает способностью фосфорилировать свободный глицерин и использовать его для синтеза ТГ.
•Избыток сахара в крови ведёт к усилению отложения жира, а недостаток –к мобилизации жира из жировых депо.
•Iстепень ожирения –превышение нормальной массы на 30%,•в жировой ткани депонируются трийодтиронин, выделяются эстрогены, тестостерон.
Липоидозы
•врождённые аномалии липидного обмена, связанные с накоплением липидов из-за дефицита расщепляющего фермента.
Атеросклероз – хроническая болезнь, характеризующаяся липоидной инфильтрацией внутренней оболочки артерий с последующим развитием в их стенке соединительной ткани, что приводит к органным или общим расстройствам кровообращения.
У лиц с уровнем холестерина в крови более 5, 2 ммоль/л решающее действие в развитии атеросклероза оказывают факторы риска.
Механизм развития атеросклероза
•При избытке в крови ЛПНП происходит их инфильтрация в клетки кровеносных сосудов.
•Холестерин стимулирует деление этих клеток и миграцию фибробластов.
•Разрастание соединительной ткани приводит к образованию атеросклеротических бляшек, рубцов, отложению кальция.
3. У больного наследственный дефект синтеза фермента глюкозо-6-фосфатазы. Будет ли при этом происходить мобилизация гликогена и выход глюкозы в кровь в промежутках между приемами пищи? Каким в итоге будет содержание гликогена в печени и глюкозы в крови?
Билет 2 нет
Билет 3.
1. Классификация гормонов по локализации рецепторов. Вторичные посредники действия гормонов.
Классификация гормонов по локализации рецепторов
· Гормоны, связывающиеся с внутриклеточными рецепторами в клетках-мишенях. К ним относятся стероидные и тиреоидные гормоны. Все они липофильны.
После секреции связываются с транспортными белками, проходят сквозь плазматическую мембрану и связываются с рецептором в цитоплазме или ядре. Образуется комплекс гормон-рецептор. Он транспортируется в ядро, взаимодействует с ДНК, активируя или ингибируя гены, что приводит к индукции или репрессии синтеза белка, изменению количества белков (ферментов).Основной эффект достигается на уровне транскрипции генов.
цАМФ вторичный посредник для АКТГ, ТТГ, ФСГ, ЛГ, МСГ, вазопрессина, uкатехоламинов, uглюкагона, uпаратгормона, uкальцитонина, uсекретина, uтиролиберина, uлипотропина.
Кальций -вторичный посредник для uвазопрессина, uокситоцина, uгастрина, uхолецистокинина, uангиотензина, uбрадикинина, uсеротонина.
Механизм действия
Содержание кальция внутри клеток мало.
1.Гормон действует на рецептор G-белок, Са поступает в клетку
Са действует на активность ферментов, ионных насосов, каналов проницаемости.
2.Механизм действия:
Са-кальмодулин Инициация Фосфорилирование протеинкиназы белков
Кальмодулин –белок, связывающий кальций.
Комплекс Са-кальмодулин изменяет активность ферментов двумя способами:
1. путём прямого взаимодействия с ферментом-мишенью,
2. через активируемую этим комплексом протеинкиназу.
активирует аденилатциклазу только при низких концентрациях кальция, а при дальнейшем повышении концентрации кальция происходит ингибирование аденилатциклазы.
uспособен активировать фосфодиэстеразу млекопитающих.
Са-кальмодулин –вторичный посредник для вазопрессина и катехоламинов.
2. Гемоглобин, его структура, синтез, виды. Гемоглобинозы.
Характеристика структуры гемоглобина
Гемоглобин –глобулярный белок, железосодержащий хромопротеин.В состав гемоглобина входят 574 аминокислоты.Молекулярная масса гемоглобина –64500.Гемоглобин состоит из 4 цепей белка глобина и четырёх гемов.
Гем
Гем -это соединение
циклического тетрапиррола –порфирина с железом.
Атом железа имеет 6 связей: четыре –с атомами азота пиррольных колец, пятая –с гистидином, шестая –для связывания с кислородом.
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Глобин -белок типа альбуминов
синтезируется в нормобластах
состоит из четырёх полипептидных цепей: 2α -цепи по 141 АМК, 2β -цепи по 146 АМК.
содержит много гистидина.
Первичная структура –последовательность АМК,
соединённых пептидной связью.
Вторичная структура –α-спираль.
Спирализованные неподвижные участки (70%) прерываются подвижными неспирализованными.
Третичная структура –глобулярный белок.
Четвертичная структура –белок состоит из 4х полипептидных цепей, уложенных относительно друг друга.
С каждой цепью связан один гем.
3, У пациента наблюдается быстрая утомляемость, неспособность к выполнению физической работы. При исследовании клеток мышц, взятых путем биопсии, обнаружили большие включения триглицеридов, концентрация карнитина в 5 раз меньше. Почему при данном заболевании резко снижается способность выполнять длительную физическую нагрузку? Напишите формульно процесс, участником которого является карнитин.
Билет3 нарушение В-окисления,т.к гипогликемия
Билет 4.
1. Белки плазмы крови, место их синтеза, биологическая роль. Изменения белкового спектра сыворотки крови при различных заболеваниях. Белки "острой фазы".
Белки плазмы крови 65-85 г/л.
· альбумины 37-55 г/л, глобулины 20-30 г/л, фибриноген 2-4 г/л.
Синтез белков
1.В печени синтезируются альбумины, фибриноген, 80% глобулинов (все α-глобулины и частично β-глобулины).
2.В-лимфоциты синтезируют иммуноглобулины.
3.Макрофаги синтезируют α2-макроглобулины, белки системы комплемента.
4.Эритропоэтин синтезируется клетками почек.
Катаболизм белков плазмы происходит: в клетках эндотелия капилляров, в мононуклеарных фагоцитах, в клетках почечных канальцев.
Функции белков плазмы крови
1. Регуляция агрегатного состояния крови:
· свёртывание,
· фибринолиз,
· калликреин-кининовая система,
· система комплемента.
2. Транспортная функция.
3. Защитная функция (антитела).
4. Регуляторная функция.
5. Ферменты.
6. Резерв аминокислот.
7. Поддержание рН крови.
8. Регуляция распределения внеклеточной жидкости.
9. Буферная функция.
10. Поддержание онкотического давления.
Белки острой фазы. Понятие «белки острой фазы» объединяет до 30 белков плазмы крови, участвующих в совокупности реакций воспалительного ответа организма на повреждение. Белки острой фазы –маркеры повреждения и воспаления. Их концентрация повышается при воспалении, беременности, онкологических заболеваниях.Концентрация существенно изменяется и зависит от стадии, течения заболевания, массивности повреждения.Концентрация увеличивается в течение первых 24-48 часов.
Белки острой фазы синтезируются в печени, являются гликопротеинами по химической природе,
К белкам острой фазы относятся: α1–гликопротеин, α1–АТ, церулоплазмин, гаптоглобин, СРП, гемопексин, фибриноген.
2. Глюкоза крови, пути ее поступления и использования. Гексокиназная реакция – ключевая реакция углеводного обмена. Пути превращения глюкозо-6-фосфата.
Наиболее распространенный углевод в животном организме — глюкоза. Она играет роль связующего звена между энергетическими и пластическими функциями углеводов, поскольку из глюкозы могут образовываться все другие моносахариды, и наоборот — различные моносахариды могут превращаться в глюкозу.
Более 90% всех растворимых низкомолекулярных углеводов крови приходится на глюкозу; кроме того, в небольших количествах могут присутствовать фруктоза, мальтоза, манноза и пентозы, а при патологии и галактоза. Наряду с ними в крови содержатся связанные с белками полисахариды.
Особенно интенсивно глюкозу потребляют ткани центральной нервной системы, эритроциты, мозговое вещество почек. В промежуточном обмене глюкоза используется для образования гликогена, глицерина и жирных кислот, аминокислот, глюкуроновой кислоты и гликопротеинов. Концентрация глюкозы в крови является производной процессов гликолиза и окисления трикарбоновых кислот в ЦТК, гликогенеза и гликогенолиза в печени и мышечной ткани, глюконеогенеза в печени и почках, поступления глюкозы из кишечника.
В клинической практике обычно исследуют содержание глюкозы в крови, к определению концентрации других сахаров и гликогена прибегают значительно реже. В крови человека глюкоза довольно равномерно распределена между плазмой и форменными элементами, установлено, что в венозной крови содержание сахара на 0,25‑1,0 ммоль/л (в среднем на 10%) меньше, чем в артериальной и капиллярной. Известную диагностическую ценность представляет определение молочной и пировиноградной кислот, активности ряда ферментов углеводного обмена, сиаловых и гексуроновых кислот, серомукоидов, гликозилированного гемоглобина и других показателей.
Содержание глюкозы в моче зависит от ее концентрации в крови, хотя выделяется она как при нормальном, так и при повышенном уровне сахара крови. При повышении концентрации глюкозы в крови преодолевается так называемый почечный порог (у здоровых людей лежит в области 8,3‑9,9 ммоль/л) и наступает глюкозурия. При артериосклеротической почке, при диабете порог повышается и может не отмечаться глюкозурия даже при повышении концентрации глюкозы до 11,0‑12,1 ммоль/л.
Методы определения глюкозы в крови подразделяют на три
Фосфорилирование (активация) -первая стадия любых дальнейших превращений моносахаридов

Гексокиназная реакция –ключевая реакция углеводного обмена.
Гексокиназа
•обладает высоким сродством к глюкозе, то есть скорость реакции максимальна при низкой концентрации субстрата (Км <0,1 ммоль/л), ингибируется глюкозо-6-фосфатом.
Глюкокиназа
•имеет Км –10 ммоль/л, •не ингибируется глюкозо-6-фосфатом,•есть только в печени.
Активность глюкокиназы в 10 раз больше активности гексокиназы. Во время пищеварения в печень поступают большие количества глюкозы, возрастает активность глюкокиназы, что предотвращает чрезмерное повышение уровня глюкозы в периферической крови.
Пути превращения глюкозо-6-фосфата в организме

3. Гиперпаратиреоидизм - заболевание, в основе которого лежит гиперпродукция паратгормона. У больных отмечается мышечная слабость, остеопороз, деформация костей, образование почечных камней. Как меняется концентрация кальция в крови у таких больных? За счет стимуляции каких процессов это происходит?
Билет 5.
1. Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс-потенциалы ферментных систем. Ингибиторы переноса электронов.
Дыхательная цепь – последовательность оксидоредуктаз во внутренней мембране митохондрий, осуществляющих перенос электронов и протонов от субстрата на молекулярный кислород.
Дыхательная цепь включает 4 ферментных комплекса, катализирующих окисление НАДН+Н кислородом.
НАДН-KoQ-редуктаза катализирует перенос электронов от НАДН к KoQ.
Этот комплекс включает в себя:
•НАДН-дегидрогеназу,
•негемовые FeS–кластеры,
•липиды,
•белки.
НАДН-дегидрогеназа
§флавопротеин,
§находится во внутренней мембране митохондрий.
§Коферментом является ФМН, который принимает электроны от НАДН+Н.
ФМН + НАДН+Н ¨ФМНН2+НАД
В FeS–белках железо связано с остатком серы.
Сукцинат-KoQ-редуктаза катализирует перенос электронов от сукцината к KoQ
Этот комплекс включает в себя:
•СДГ,
•негемовое Fe,
•липиды,
•белки.
СДГ-флавопротеин, прочно связан с внутренней мембраной митохондрий.
Коферментом является ФАД.
KoQ(убихинон)
•Источники убихинона –витамины К и Е.
•KoQрасположен в дыхательной цепи между флавиновыми ферментами и цитохромами.
KoQ+ ФМНН2 ¨ KoQН2 + ФМН
Убихинон –коллектор, так как собирает восстановленные эквиваленты не только от НАДН-ДГ, но и от СДГ и других компонентов.
Редокс-потенциал
•Редокс-потенциал указывает направление переноса электрона.
•При сравнении редокс-потенциала системы с нормальным водородным электродом, потенциал которого равен нулю, получают величины, отражающие окислительно-восстановительные способности вещества.
Ингибиторы дыхания
1.Инсектицид ротенон блокирует НАДН-ДГ. Барбитураты блокируют переход от ФП к убихинону.
2.Антимицин А блокирует стадию: цитохром В ¨ цитохром С.
3.Цианиды, угарный газ –ингибиторы цитохромоксидазы. Синильная кислота реагирует с Fe
2. Адреналин и норадреналин, их синтез и влияние на обмен веществ.
Катехоламины (адреналин, норадреналин, дофамин)
l гормоны мозгового слоя надпочечников,
l производные тирозина.
Органы-мишени:
l печень,
l мышцы.
Секреция гормонов возбуждается симпатическими нервами.
Синтез катехоламинов

Механизм действия
l uчерез цАМФ, в клетку не проникают,
l uчерез изменение концентрации ионов кальция.
Оба гормона вызывают гипертонию.
| Адреналин | Норадреналин |
| Свободная СН3 группа | Свободная NH2группа |
| Возбуждает в-рецепторы | Возбуждает а-рецепторы |
| Расширяет бронхи | Сужает бронхи |
| Расширяет сосуды мозга, мышц | Сужает сосуды мозга, мышц |
| Стимуляция коры, возбуждает ЦНС | Действует слабее |
| Тахикардия | Брадикардия |
| Расслабляет гладкие мышцы, расширяет зрачок | Действует слабее |
Биохимическое действие адреналина
l uусиливает распад гликогена в печени, вызывая гипергликемию,
l uусиливает распад гликогена в мышцах, при этом увеличивается концентрация молочной кислоты, стимулирует фосфорилазу, ингибирует гликогенсинтазу,
l uугнетает секрецию инсулина (сбережение глюкозы для ЦНС)
Норадреналин в 4-8 раз слабее адреналина действует на а-адренергические рецепторы через изменение концентрации кальция (влияет на сокращения гладких мышц)
3. Оценить состояние больного по следующим данным анализа крови и мочи: общий билирубин - 80 мкмоль/л (повышение как прямого, так и непрямого билирубина), общий белок снижен, белковые фракции: альбумины - снижены, альфа- и гамма-глобулины - повышены, активность АЛТ - повышена, коэффициент де Ритиса меньше 1,0.
Билет 5 Паренхиматозная желтуха
Билет 6.
1. Особенности обмена в эритроцитах. Эритроцитарные энзимопатии. Синтез гема. Порфирии.
Эритроцитарные энзимопатии
Недостаточность Г-6-ФДГ в эритроцитах
•возникает из-за замены аминокислоты в структуре фермента,•1/20 человечества имеет этот дефект,•чаще встречается у мужчин,•возникают острые гемолитические кризы и гемолитическая анемия.
Характеристика структуры гемоглобина.
Гемоглобин –глобулярный белок, железосодержащий хромопротеин.В состав гемоглобина входят 574 аминокислоты.Молекулярная масса гемоглобина –64500.Гемоглобин состоит из 4 цепей белка глобина и четырёх гемов.
•Гем -это соединение циклического тетрапиррола –порфирина с железом.
•Атом железа имеет 6 связей: четыре –с атомами азота пиррольных колец, пятая –с гистидином,
шестая –для связывания с кислородом.


Синтез гема -энергозависимый процесс.
Стимуляторы синтеза: •ионы железа,•ионы меди,•витамин В12.
δ-Аминолевулинатсинтаза активируется стероидами и ингибируется гемом.
Эритропоэтин (синтезируется в печени) стимулирует синтез ферментов образования гема.
Порфирины
Пигменты порфирины синтезируются в ходе образования хромопротеинов (гемоглобина).
Выделяются с мочой, калом, желчью.В норме с мочой выделяется 150 мкг порфиринов в сутки.
Порфиринурия –увеличенное выделение порфиринов с мочой.
Первичные порфирии-врождённые расстройства синтеза гема, обусловленные недостаточностью фермента, участвующего в его образовании.
Болезнь Гюнтера –врождённая порфирия: блок синтеза гема. С мочой выделяются уро-и копропорфирины.Клинические проявления: красная моча,розовые зубы,фотодерматоз, гемолитическая анемия,спленомегалия.
Острая порфирия –блок превращения порфобилиногена в полипирролы. С мочой выделяются порфобилиноген и аминолевулинат.Клинические проявления:острые приступы с абдоминальными и неврологическими симптомами.
Вторичные порфиринурии
возникают при циррозе печени, болезнях крови, аллергиях.
2. Процессы переваривания белков в кишечнике. Протеолитические ферменты панкреатического и кишечного соков. Гниение аминокислот в кишечнике и обезвреживание продуктов.
Всасывание АМК в кровь
•происходитв тонком кишечнике,•сопровождается потреблением энергии.
Судьба всосавшихся АМК
•Всасываемые АМК попадают в портальный кровоток, а затем в общий кровоток.
•Особенно интенсивно АМК поглощают печень и почки.
•Ткань мозга избирательно быстро поглощает мет, гли, гис, арг, глутамин, тир, а лей, лиз, про поглощаются этой тканью медленно.
Всасывание продуктов распада белков
•идёт путём активного транспорта (с ионами натрия) АМК в кровь,
•если белок всасывается непереваренным, то к этому белку –аллергия.
Специфические транспортные системы существуют для
•нейтральных АМК с небольшой боковой цепью,
•нейтральных АМК с объёмной боковой цепью,
•основных АМК,
•кислых АМК,
•пролина.
Ферменты панкреатического сока
•трипсин,•химотрипсин,•эластаза,•карбоксипептидаза.
Пищеварительные протеолитические ферменты вырабатываются в неактивном состоянии
•предупреждение переваривания органов,•предупреждение переваривания ферментов.
Групповая специфичность ферментов поджелудочной железы
•Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы Лиз и Арг.
•Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК.
Кишечный сок
•аминопептидазы, •дипептидазы, •энтерокиназа.
Гниение белков
•5% белка не переваривается, а идёт в толстый кишечник, где микрофлорой расщепляется до АМК.
•Гниение белков –распад АМК, белков в толстой кишке под действием ферментов бактерий.
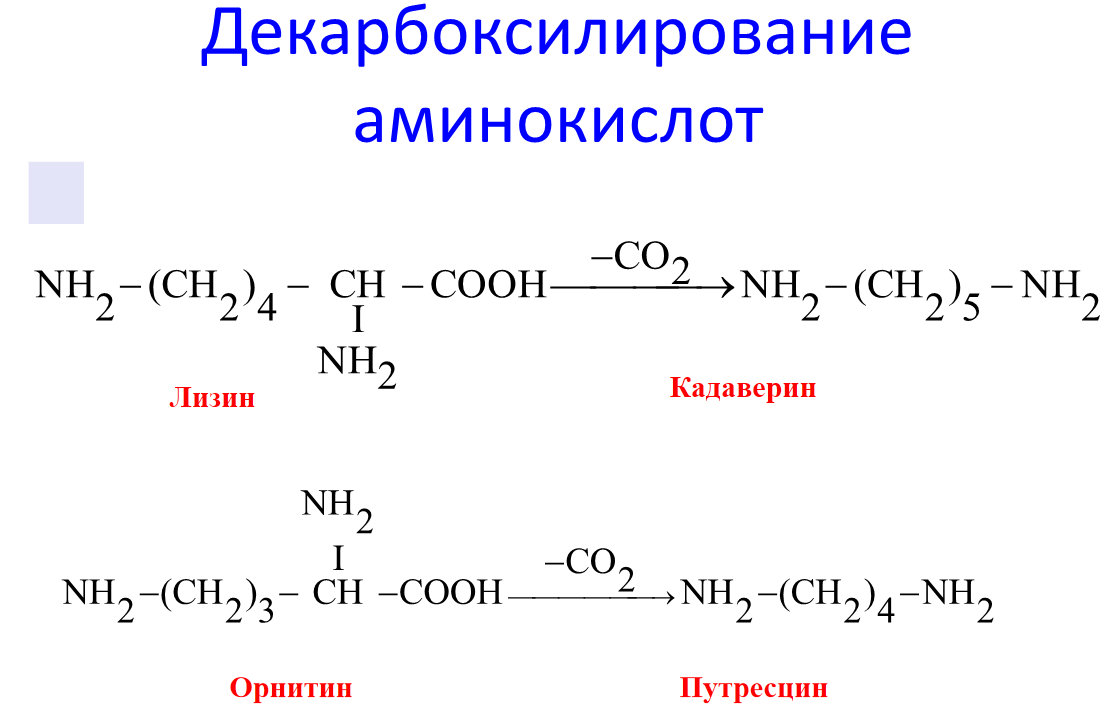
Диамины обезвреживаются в организме под действием фермента ДАО (диаминооксидаза), кофермент –ФП.


Моноамины обезвреживаются ферментом МАО (моноаминооксидаза), кофермент –ФАД.
•Глубокий распад серосодержащих АМК (сероводород, меркаптан).
•При гниении образуются токсичные для организма продукты: аммиак, сероводород, фенол, крезол, индол, скатол, различные диамины, моноамины, бензойная кислота.
•Процессы гниения усиливаются при дефиците протеолитических ферментов поджелудочной железы. Возникает аутоинтоксикация.
3.Оцените состояние больного по следующим данным анализа крови и мочи: глюкоза крови – 10,0 ммоль/л, рН крови – 7,30, в моче обнаружены глюкоза, кетоновые тела.
Билет 6 Сах диабетàметаболический ацидоз
Билет 7.
1. Эндокринная система организма. Классификация гормонов по химической структуре, их роль в регуляции обменных процессов. Причины эндокринных заболеваний. Механизм действия гормонов.
Классификация гормонов по химической природе
-Белки: простые –инсулин, СТГ, сложные –ТТГ, ФСГ,
-Пептиды: вазопрессин, окситоцин, глюкагон, тиреокальцитонин, АКТГ, соматостатин.
-Производные АМК: адреналин, тироксин.
-Гормоны стероидной природы.
-Производные жирных кислот: простагландины.
· Связь между эндокринной и нервной системой.
Поиск по сайту: