 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Влияние внешних факторов на химическое равновесие
Качественная картина влияния внешних факторов на химическое равновесие дается принципом Ле-Шателье:
Если на систему, находящуюся в равновесии оказывать внешнее воздействие, то равновесие будет смещаться в сторону процесса, противодействующего этому воздействию.
· Влияние давления.
Повышение давления, согласно принципу Ле-Шателье, должно смещать равновесие в сторону образования меньшего количества моль газообразных продуктов.
Количественную картину получают с помощью закона действия масс. Для этого Константу рвновесия необходимо связать с внешним давлением. Это можно сделать, связав равновесные парциальные давления через степень термической диссоциации – α.
Степень термической диссоциации – отношение числа молекул данного сорта, продиссоциировавших на более простые молекулы, к общему числу молекул данного сорта:

|
2. Влияние температуры на химическое равновесие находится в соответствии с принципом Ле-Шателье
При повышении температуры равновесие экзотермических реакций смещается в сторону исходных веществ, а при понижении температуры – в сторону продуктов реакции и наоборот.
Влияние температуры на константу равновесия химической реакции выражается уравнениями изобары и изохоры Вант-Гоффа, которые получается путем приложения уравнения Гиббса-Гельмгольца к химическим реакциям:
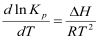
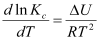 ,
,
где = QP, U = Qv.
Зная зависимость константы равновесия от температуры, по этим уравнениям можно вычислить тепловой эффект реакции при данной температуре.
В интегральной форме уравнения изобары и изохоры Вант-Гоффа имеют вид соответственно (для небольшого температурного интервала):
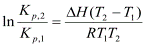
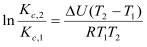
Поиск по сайту: