 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Первое начало термодинамики. Энтальпия
Первое начало термодинамики - один из трех основных законов термодинамики, представляющий собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы.
Согласно первому началу термодинамики, термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Формулировка I закона термодинамики:
Невозможно построить такую машину, которая, совершая произвольное число раз один и тот же циклический процесс, приводила бы к накоплению энергии в изолированной системе. То есть вечный двигатель I рода невозможен.
Первое начало термодинамики объясняет невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Сущность первого начала термодинамики заключается в следующем:
При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы Δ U и система совершает работу А:
| Q = Δ U + A | (1.4) |
где Q – теплота, ΔU – изменение внутренней энергии, А – работа (pV, p – давление, V объем).
Уравнение (1.4), выражающее первое начало термодинамики, является определением изменения внутренней энергии системы (Δ U), так как Q и А — независимо измеряемые величины.
Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): А ад = — Δ U, что определяет U с точностью до некоторой аддитивной постоянной U0:
| U = U + U0 | (1.5) |
Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние (в то время как значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамических свойств физической системы первое начало термодинамики обычно применяется совместно со вторым началом термодинамики.
Химические процессы протекают обычно либо при постоянном давлении (изобарные), либо при постоянном объёме (изохорные). В химии чаще всего приходится иметь дело с изобарными процессами. Чтобы уяснить смысл понятия энтальпия, рассмотрим следующий пример. Допустим, система переходит из одного состояния в другое:
Сосуду, заполненному газом, сообщили некоторое количество тепла, и в 1 случае выдерживается постоянный объём, а во 2 – газ может свободно расширяться.
В 1 случае сообщённое тепло QU полностью пойдёт на изменение внутренней энергии системы Q = ΔU (1)
Во 2 случае тепло расходуется на изменение внутренней энергии ΔU и на работу А.
Qp= ΔU + A (2),
где А – работа по перемещению поршня
Qp= ΔU + p ΔV (3),
где р – давление, ΔV – изменение объёма системы.
Формулу (3) можно переписать в следующем виде:
Qp=(U2 – U1) + p(V2 – V1) (4)
Qp=(U2 + pV2) – (U1 + pV1) (5)
В этом выражении параметры в скобках обозначим Н, т.е.
U2 + pV2 = Н2, U1 + pV1=Н1, тогда Qp= Н2 – Н1 =ΔН.
Так, путём рассуждений мы пришли к новой термодинамической функции Н: проведён изобарный процесс, система перешла из одного состояния в другое, энергия системы увеличилась, и охарактеризовать её можно энтальпией. Энтальпия – энергия расширенной системы, или внутреннее теплосодержание системы.
Для экзотермических реакций Q > 0, ΔH < 0
Для эндотермических реакций Q < 0, ΔH > 0.
Количество теплоты, выделяющееся или поглощающееся при реакции, называется тепловым эффектом реакции.
Изучением теплот химических реакций занимается термохимия.
При исследовании тепловых эффектов разных реакций выведен ряд закономерностей. Так, например, экспериментально установлено, что тепло, выделяющееся при образовании сложного вещества из простых равно теплу, поглощаемому при разложении такого же его количества на составные части. Это явление следует рассматривать как частный случай закона сохранения энергии (з-н Лавуазье – Лапласа).
Более глубокое обобщение термохимических закономерностей даёт основной закон термохимии – закон Гесса:
Тепловой эффект химических реакций, протекающих при постоянном давлении или при постоянном объёме, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Например, вещество АВ можно получить из А разными способами:
1) А + В = АВ (ΔН)
2) А + С = АС (ΔН1)
АС + В = АВ + С (ΔН2)
ΔН1 + ΔН2 = ΔН

В термодинамике принята следующая запись теплот химических реакций:
С(тв) + О2(г) = СО2(г); ∆НР = -405,8 кДж;
в термохимии: С(тв) + О2(г) = СО2(г) + 405,8 кДж.
∆Н0 указывает на стандартное состояние (Р = 1 атм, Т = 298 К). Реагирующие вещества берутся в том агрегатном состоянии и в виде той кристаллической модификации, которые наиболее устойчивы при данных условиях.
В термодинамике считается положительной (+) теплота, поглощенная системой (эндотермический процесс), а в термохимии – выделяемая в результате реакции (экзотермический процесс).
В термохимии пользуются понятием «теплота (энтальпия) образования вещества». Под теплотой образования понимают тепловой эффект реакции образования одного моль вещества из простых веществ.
Существует также понятие «стандартная теплота образования вещества» - тепловой эффект реакции образования одного моль вещества из простых веществ в стандартных условиях ( ΔН0298) (при 298 К и 1 атм)
Обычно теплоты образования простых веществ в стандартных условиях принимают равными нулю. Теплоты образования приводятся в справочниках.
Большое значение закона Гесса заключается в том, что, пользуясь им можно вычислить неизвестную теплоту реакции путем комбинирования стехиометрических уравнений и теплот других реакций, изученных экспериментально. При этом необходимо сравнивать теплоты различных реакций в одних и тех же условиях.
Пример: Определить тепловой эффект реакции на основе экспериментальных данных при 0°С и давлении 1 атм.
· С + О2 = СО2; ∆НР,1 = -405,8 кДж
· СО + ½ О2 = СО2; ∆НР,2 = -284,5 кДж
______________________________________
3) С + ½ О2 = СО; ∆НР,3 -?
(3) = (1) – (2)
Проверка: С + О2 - ½ О2 – СО = СО2 - СО2;
С + ½ О2 = СО.
∆НР,3 = ∆НР,1 - ∆НР,2 = -405,8 кДж – (-284,5 кДж) = 121,3 кДж.
Для расчетов по закону Гесса часто пользуются теплотами сгорания органических соединений, которые можно довольно легко определить экспериментально.
Теплота реакции рассчитывается по I следствию закона Гесса:
Теплота реакции равна сумме теплот сгорания начальных участников реакции за вычетом суммы теплот сгорания конечных участников реакции с учетом стехиометрических коэффициентов.

где νн, νк - стехиометрические коэффициенты.
Пример для реакции а А + b B→ d D *
∆Hреакц. = а ∆Hсгор(А) + b ∆Hсгор(B) - d ∆Hсгор(D).
• Теплотой сгорания вещества называется тепловой эффект реакции сгорания его (1 моль) с образованием устойчивых продуктов (для органических веществ это СО2 и Н2О).
Кроме теплот сгорания часто используют теплоты образования химических соединений.
• Теплотой образования вещества называется теплота образования
1 моль его соединения из соответствующих простых соединений (обычно при Р = const).
Простые вещества реагируют в виде той модификации и в том агрегатном состоянии, которые наиболее устойчивы при данных условиях. Теплоты образования лишь в редких случаях могут быть определены экспериментально, чаще теплоты образования рассчитывают на основе закона Гесса.
Пример: а А + b B→ d D.
∆HР = ∆Hобр(D)· d = а ∆Hсгор(А) + b ∆Hсгор(B) - d ∆Hсгор(D);

Соединения, теплоты образования которых положительны, называются эндотермическими, а теплоты образования, которых отрицательны - экзотермическими.
В целях сопоставления и использования для расчетов по закону Гесса теплоты огромного количества реакций (химических соединений) рассчитаны для стандартных условий:Р = 1 атм (101300 Па); Т = 298 К (25 °С) и сведены в таблицы стандартных величин (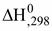 или
или  ) (стандартные теплоты образования).
) (стандартные теплоты образования).
Пользуясь стандартными значениями можно рассчитать тепловой эффект любой реакции (при стандартных условиях) по II следствию закона Гесса:
Теплота реакции равна сумме теплот образования конечных веществ за вычетом суммы теплот образования начальных веществ с учетом стехиометрических коэффициентов.
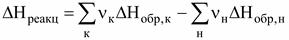
|
Или для стандартных условий:

|
Пример: а А + b B→ d D
∆HР = d ∆Hобр(D) – (а ∆Hобр(А) + b ∆Hобр(B)) = d ∆Hобр(D) - а ∆Hобр(А) - b ∆Hобр(B).
При этом величина и знак теплоты образования характеризуют устойчивость соединения в данных условиях.
Например:
| NH3 | PH3 | AsH3 | SbH3 | BiH3 |
| - 46,15 кДж/моль | +12,56 | +66,38 | +145 | - |
Чем меньше ΔН, тем более устойчиво соединение. При образовании NH3 выделяется тепло. Далее в приведённом ряду теплоты образования возрастают, и, следовательно, устойчивость соединений падает. А гидрид висмута разлагается при получении.
NH4Cl = NH3 + HCl↑
Из справочника выпишем энтальпии веществ:
| Вещество | NH3 | HCl | NH4Cl |
| ΔН0298, кДж/моль | - 46,15 | - 92,3 | -315 |
По этим данным можно рассчитать тепловой эффект хим реакции, пользуясь 2 следствием из закона Гесса.
ΔН0298(реакции) = ΔН0298(HCl) + ΔН0298(NH3) - ΔН0298(NH4Cl) = 176,55 кДж/моль
Тепловой эффект положителен, т.е. реакция эндотермическая, а, значит, чтобы разложить NH4Cl, его нужно нагреть.
Если известен тепловой эффект реакции, то можно рассчитать и теплоту образования вещества, участвующего в реакции. Закон Гесса позволяет также рассчитывать теплоты образования неустойчивых соединений и тепловые эффекты реакций, которые нельзя осуществить экспериментально. На практике тепловой эффект реакций измеряют с помощью калориметра.
Величина ΔН зависит от агрегатного состояния вещества, поэтому в термохимических уравнениях указывают агрегатное состояние веществ. Закон Гесса является следствием первого начала термодинамики и справедлив при постоянном объёме или постоянном давлении.
Поиск по сайту: