 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Способы выражения концентрации растворов. Важной характеристикой растворов является концентрация
Важной характеристикой растворов является концентрация.
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Массовая доля компонента (wi) - это отношение массы данного компонента к массе раствора, которая в процентах определяется соотношением:
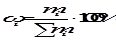 ,
,
где  - масса растворенного вещества, а
- масса растворенного вещества, а 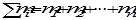 - суммарная масса всех компонентов раствора.
- суммарная масса всех компонентов раствора.
Мольность (С i) определяется числом моль вещества в единице объема раствора. В системе СИ она выражается в моль/м3.
Молярная концентрация или молярность (СМ) равна числу моль растворенного вещества, содержащихся в 1 л раствора. Раствор, содержащий в 1 л 1 моль растворенного вещества, называется одномолярным или молярным; 0,1 моль—децимолярным (0,1 М раствор); 0,01 моль — сантимолярным и т. д.
Эквивалентная концентрация или нормальность (СН) равна числу моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Раствор называется однонормальным, или нормальным, если в 1 л его содержится 1 моль-экв растворенного вещества (1 н раствор); полунормальным, если он содержит 0,5 моль-экв в 1 л (0,5 н раствор) и т. д.
Моляльная концентрация или моляльность (Сm) равна числу моль растворенного вещества в 1000 г растворителя. Если раствор состоит только из растворенного вещества и растворителя, моляльность растворенного вещества обозначают Сm,2. Ее можно рассчитать по формуле
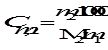 ,
,
где m 1 и m 2 – массы растворителя и растворенного вещества соответственно, М2- молярная масса растворенного вещества. Так как количество вещества в молях 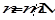 , то
, то
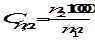 ,
,
где n 2 – количество моль растворенного вещества в m1 граммах растворителя.
Мольной долей (хi) компонента называется число молей компонента, приходящихся на один моль раствора. Мольная доля i- го компонента равна отношению числа молей i-го компонента (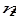 ) к сумме чисел молей всех компонентов в растворе (
) к сумме чисел молей всех компонентов в растворе (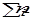 ) и определяется соотношением:
) и определяется соотношением:
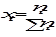 ,
,
где 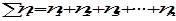
Если раствор состоит только из растворенного вещества и растворителя, мольную долю растворенного вещества обозначают х2, а растворителя – х1. При любом количестве компонентов раствора сумма мольных долей всех компонентов равна 1:
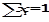 ,
,
тогда для бинарного раствора 
Растворы представляют собой дисперсные системы, в которых частицы одного вещества равномерно распределены в другом. Свойства дисперсных систем, в первую очередь их устойчивость, зависят от размеров распределенных частиц. В зависимости от степени дисперсности различают взвеси, коллоиды и истинные растворы.
Частицы взвесей имеют обычно размер 10-3 —10-5 см. Их характерной особенностью является неустойчивость во времени: взвешенные частицы (диспергированная фаза) либо оседают, либо всплывают на поверхность в зависимости от соотношения плотностей. Если распределенное вещество находится в виде отдельных молекул, система является устойчивой и не разделяется при длительном стоянии. Такие растворы называют истинными или молекулярными. Промежуточными между истинными растворами и взвесями являются коллоидные растворы. Размеры частиц коллоидных растворов лежат в интервале 10-5 – 10-7 см, а истинных — менее 10-7 см.
Поиск по сайту: