 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Изотерма Фрейндлиха
|
Читайте также: |
Для средних заполнений поверхности адсорбента используют уравнение изотермы Фрейндлиха:
Г = 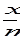 = k
= k 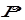 (адсорбция из газовой фазы);
(адсорбция из газовой фазы);
Г = 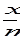 = k
= k  (адсорбция из раствора),
(адсорбция из раствора),
где x - количество адсорбированного вещества, моль, m - масса адсорбента в граммах, k и α- константы. Физический смысл k - это величина адсорбции при С или Р, равных 1. α характеризует степень приближения изотермы адсорбции к прямой. Обычно при адсорбции из газовой фазы α = 0,2-1,0, a из растворов — α = 0,1-0,5. Константы уравнения Фрейндлиха определяются графически после логарифмирования:
lgГ=lgk+ α lgC.
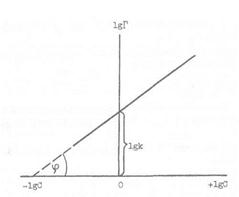
Рис. 3. Зависимость lgГ = f(lgC) к уравнению Фрейндлиха
На рис. 3 показана зависимость lgГ - lgC, выражающаяся в виде прямой линии: tgφ = α. Экспериментально величина адсорбции Г из раствора на твердом адсорбенте рассчитывается по формуле:
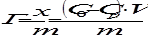 моль/г,
моль/г,
где С0 и СР - соответственно молярная концентрация до и после адсорбции, т - масса адсорбента в г, V - объем раствора, из которого происходила адсорбция в литрах.
Поиск по сайту: