 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ДИФФУЗИЯ. ЗАКОН ФИКА
Диффузия – процесс самопроизвольного выравнивания концентрации молекул, ионов, кол.частиц под влиянием их теплового или броуновского движения. Диффузия является макроскопическим проявлением теплового движения и поэтому идет тем быстрее, чем выше температура. Явление диффузии необратимо, она протекает до полного выравнивания концентраций, так как хаотическому распределению частиц отвечает максимальная энтропия системы.
Движущей силой диффузии является градиент концентрации или степень невыравненности концентрации, т.е. изменение концентрации, приходящееся на единицу расстояния. Диффузия заканчивается с наступлением равновесия, для которого характерно равномерное распределение частиц по всему объему системы. Явление диффузии универсально, происходит и в истинных, и в кол.р-рах. Различие между этими растворами количественное, в скорости диффузии из-за размеров частиц.
Скорость диффузии выражается законом Фика  , где m-количество (моль) продиффундировавшего вещества; t - продолжительность диффузии; S – площадь сечения сосуда, через который протекает диффузия; dc/dx – градиент концентрации; D – коэффициент диффузии, зависящий от свойств диффундирующих частиц и среды. Знак - поставлен потому, что градиент концентрации имеет отрицательное значение, т.е. диффузия протекает в направлении уменьшения концентрации.
, где m-количество (моль) продиффундировавшего вещества; t - продолжительность диффузии; S – площадь сечения сосуда, через который протекает диффузия; dc/dx – градиент концентрации; D – коэффициент диффузии, зависящий от свойств диффундирующих частиц и среды. Знак - поставлен потому, что градиент концентрации имеет отрицательное значение, т.е. диффузия протекает в направлении уменьшения концентрации.  - скорость диффузии, или поток диффузии, выражает количество вещества, диффундирующего в единицу времени через единичную площадь, пропорциональна градиенту концентрации. D – коэффициент пропорциональности. Физический смысл D легко понять переписав уравнение в виде
- скорость диффузии, или поток диффузии, выражает количество вещества, диффундирующего в единицу времени через единичную площадь, пропорциональна градиенту концентрации. D – коэффициент пропорциональности. Физический смысл D легко понять переписав уравнение в виде  и приняв
и приняв 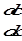 =1; S=1; t=1, тогда dm численно равно D. D – количество вещества, диффундирующего через единичную площадь сечения, за единицу времени при единичном градиенте концентрации. D называют удельной скоростью диффузии.
=1; S=1; t=1, тогда dm численно равно D. D – количество вещества, диффундирующего через единичную площадь сечения, за единицу времени при единичном градиенте концентрации. D называют удельной скоростью диффузии.
Эйнштейн (1908) вывел уравнение, связывающее D, абс. Температуру системы Т, вязкость среды h, радиус частиц дисп. фазы 
Коэффициент диффузии прямо пропорционален Т, обратно пропорцианаленh и r3. Поскольку размеры кол.частиц велики, по сравнению с размерами молекул, постольку диффузия в кол.р-рах протекает медленно.
Зная D, используя уравнение Эйнштейна можно определить размеры кол.чатиц. Рассчитав радиус частиц, можно вычислить молярную массу вещества
М=4/3pr3rN. Перрен и Герцог, определив коэффициент диффузии в водных растворах, вычислили молярные массы некоторых углеводов, допустив, что их молекулы имеют сферическую форму.
Все экспериментальные методы определения коэффициента диффузии основаны на том, что раствор диффундирующего вещества приводят в контакт с растворителем, чтобы между ними образовалась четкая граница раздела. Систему выдерживают некоторое время при постоянной температуре и отсутствии внешних воздействий. Затем изучают наступившее в результате диффузии новое распределение концентрации растворенного вещества. Затем с помощью специальных таблиц вычисляют коэффициент диффузии.
Диффузию изучают наблюдая за броуновским движением.
Поиск по сайту: