 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Растворимость плохорастворимых электролитов
При изучении качественного анализа приходится постоянно иметь дело с реакциями осаждения и растворения осадков и пользоваться произведением растворимости. Плохорастворимые вещества всегда слабо взаимодействуют растворителем. Растворимость плохорастворимого соединения - процесс обратимый. При достижении насыщения обязательно устанавливается равновесие между нерастворенной и растворенной формами вещества. Константа равновесия зависит от температуры, природы вещества и активности перешедших в раствор частиц. В случае растворов плохорастворимых соединений концентрация частиц в растворе очень мала и их коэффициенты активности можно считать равными единице. f±=1, аi=Ci
Этот подход справедлив для плохорастворимых соединений. Если растворимость достаточная нужно учитывать коэффициент активности и ионную силу раствора.
S mSnS
KmAn«mKn+ + nAm-
Если концентрация исходной соли равна S, то при диссоциации в раствор перейдет mS катионов и nS анионов.
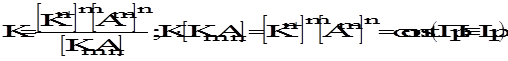
Lp = (mS)m×(nS)n
Lp = Sm+nmmnn
 - растворимость плохорастворимого электролита.
- растворимость плохорастворимого электролита.
Для бинарного электролита (KA) 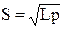
K2A, KA2, - 
K3A, KA3 - 
Поиск по сайту: