 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Таким чином
 , (ХІ.9.9)
, (ХІ.9.9)
або
 , (ХІ.9.10)
, (ХІ.9.10)
 де k0 = еВ.
де k0 = еВ.
З цього рівняння видно, що константами, які характеризують реакцію, є передекспоненціальний множник k0 і енергія активації Е. Для визначення енергії активації будують графіки залежності логарифма константи швидкості lnk від оберненої температури.
При цьому, якщо закон, що виражається рівнянням Арреніуса, виконується, то отримується пряма лінія. Дійсно,
 . (ХІ.9.11)
. (ХІ.9.11)
В координатах lnk і 1/Т - є рівняння прямої (рис. 61).
Тангенс кута нахилу прямої tgφ, очевидно, дає значення E/R, а відрізок, що відсікається прямою на вісі ординат, рівний lnk0. Зрозуміло, що розрахунок можна здійснити і аналітично. Для цього вимірюють константу швидкості при двох різних температурах Т1 і Т2 і сумують вираз для lnk.
Маємо
 , (ХІ.9.12)
, (ХІ.9.12)
 , (ХІ.9.13)
, (ХІ.9.13)
 , (ХІ.9.14)
, (ХІ.9.14)
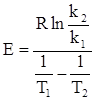 . (ХІ.9.15)
. (ХІ.9.15)
Вивчення питання про фізичну природу енергії активації привело до висновку, що активними не є лише молекули, що володіють підвищеною швидкістю поступального руху. Активація молекул має місце внаслідок переходу атомів, що входять до її складу, на підвищені коливальні рівні, або внаслідок збудження електронів. У відповідності з цим, і фактори, що сприяють появі активних молекул, різні за своєю природою. Частіше причиною активації слід вважати зіткнення молекул, при якому сумарна енергія частинок, що стикаються, перевищує середню енергію зіткнення. В деяких реакціях суттєвою причиною активації є поглинання електромагнітних коливань, зокрема, видимого світла. Електричні заряди, дія ультразвуку, розриви валентних зв’язків також можуть бути причиною активації.
Енергія активації Е при розрахунках у вузькому температурному інтервалі, зазвичай, приймається як така, що не залежить від температури. В дійності для NA молекул
 , (ХІ.9.16)
, (ХІ.9.16)
де Е а - енергія активної молекули, Ес - середня енергія молекули. Ес, очевидно, є функцією температури і вже з цього видно, що енергія активації залежить від Т.
Поиск по сайту: