 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Наприклад, це може бути розклад гідроген йодиду
2НІ ® Н2 + І2
Будемо характеризувати концентрацію з допомогою N - кількості певних молекул в одиниці об’єму суміші, а швидкість реакції - кількістю молекул, що утворились або прореагували в одиниці об’єму за одиницю часу.
Скористаємось рівнянням молекулярно-кінетичної теорії газів. Число зіткнень всіх N молекул, що знаходяться в одиниці об’єму газу, за одну секунду рівна
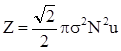 , (ХІ.11.1)
, (ХІ.11.1)
де σ - ефективний діаметр молекули. Середня арифметична швидкість молекул
 , (ХІ.11.2)
, (ХІ.11.2)
де М - молярна маса. Тому
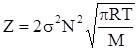 (ХІ.11.3)
(ХІ.11.3)
За законом Больцмана визначаємо число активних зіткнень, в яких енергія перевищує енергію активації:
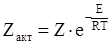 (ХІ.11.4)
(ХІ.11.4)
В результаті кожного активного зіткнення витрачається дві молекули вихідної речовини, а тому кількість прореагованих молекул в одиниці об’єму за 1 с, тобто швидкість реакції, рівна подвоєному числу активних зіткнень за цей же час і в тому ж об’ємі
 . (ХІ.11.5)
. (ХІ.11.5)
Формула для швидкості одержується після підстановки загального числа зіткнень Z у вираз для числа активних зіткнень:
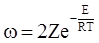 , (ХІ.11.6)
, (ХІ.11.6)
або
 . (ХІ.11.7)
. (ХІ.11.7)
Звідсіля видно, що швидкість реакції залежить від квадрату концентрації
 , (ХІ.11.8)
, (ХІ.11.8)
де
 (ХІ.11.9)
(ХІ.11.9)
Величина k, очевидно, має зміст константи швидкості, оскільки k рівна швидкості реакції при N = 1.
Виходячи з (ХІ.11.6) і (ХІ.11.8) рівняння для константи швидкості можна записати так:
 (ХІ.11.10)
(ХІ.11.10)
Співставляючи це рівняння з рівнянням Арреніуса (ХІ.9.10), можна встановити фізичний зміст передекспоненціального множника k0, який виявляється пропорційним загальному числу зіткнень всіх молекул в одиниці об’єму за одиницю часу. У випадку одиничної концентрації (N = 1) величина k0 відрізняється від Z лише коефіцієнтом 2. Можна показати, що для бімолекулярних реакцій типу А + В ® Р цей коефіцієнт рівний 1. З цієї причини рівняння Арреніуса часто пишуть у вигляді:
 , (ХІ.11.11)
, (ХІ.11.11)
де Z - число зіткнень молекул в одиниці об’єму за одиницю часу.
Величина Е, що входить в рівняння теорії активних зіткнень, називається істинною енергією активації на відміну від дослідної або ефективної, що визначається за рівнянням Арреніуса (ХІ.9.10).
Зв’язок між ефективною енергією активації Е а і істинною виражається таким рівнянням
 (ХІ.11.12)
(ХІ.11.12)
Таким чином, істинна й ефективна енергія активації не цілком відповідають одна одній. Вони відрізняються на середню енергію теплового руху молекул.
Оскільки з дослідних даних слідує, що Е а - величина стала, то передбачається, що другий член правої частини (ХІ.11.12) значно менший першого. В такому випадку зміна температури може настільки мало позначатися на зміні Е а, що практично це не буде виявлятися. Тому вважається, що Е >> ½ RТ, а Е а ≈ Е.
Користуючись теорією активних зіткнень, можна розрахувати числові значення константи швидкості реакції. Для деяких простих реакцій, що протікають у газах і розчинах, спостерігаються задовільні співвідношення розрахованих значень з дослідними. Гарне співвідношення, наприклад, відмічається для газової реакції розкладу гідроген йодиду, а також для реакції його синтезу. Однак, у більшості випадків спостерігається значне розходження розрахованих значень швидкостей реакцій з дослідними. Такі відхилення можна пояснити, передбачивши, що реагують лише молекули, які орієнтовані при зіткненнях певним чином. Тому з загального числа ефективних зіткнень, розрахованих за теорією, слід вважати дійсно ефективними лише деяку частину. За цією ж причиною вираз для константи швидкості записують так:
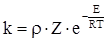 , (ХІ.11.13)
, (ХІ.11.13)
де ρ - так званий стеричний фактор або фактор імовірності.
Вважається, що стеричний фактор відрізняється від одиниці не лише тому, що для здійснення реакції необхідна певна орієнтація реагуючих молекул, а і залежністю імовірності реакції від часу взаємодії цих молекул у момент зіткнення. В тих випадках, коли зіткнення відбувається занадто швидко, молекули не встигають прореагувати.
Поняття стеричного фактора, проте, не завжди достатньо добре відповідає дослідним даним. Зустрічаються реакції, для яких величина ρ більша одиниці або занадто мала (порядку 10-8), що важко пояснити. Теорія не в змозі розрахувати величину ρ. Всі ці недоліки пов’язані з недосконалістю і формальним характером теорії активних зіткнень, що уявляє молекули реагуючих речовин у вигляді твердих кульок. З термодинамічних міркувань випливає, що стеричний фактор повинен бути пов’язаний зі зміною ентропії в ході реакції, що також не пояснюється теорією зіткнень.
Поиск по сайту: