 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.2. Швидкість хімічних реакцій
 Основною величиною кінетики є швидкість реакції. Швидкість хімічної реакції в газах і розчинах вимірюють числом молекул (або молей) даної речовини, що реагують в одиницю часу в одиниці об¢єму.
Основною величиною кінетики є швидкість реакції. Швидкість хімічної реакції в газах і розчинах вимірюють числом молекул (або молей) даної речовини, що реагують в одиницю часу в одиниці об¢єму.
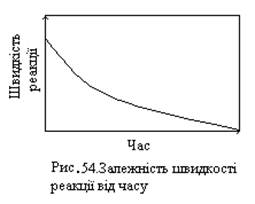
Очевидно, що швидкість можна визначити за зміною кількості будь-якої речовини, яка реагує, чи продуктів реакції, що утворилися. В міру витрачання вихідних речовин швидкість процесу зменшується (рис. 54), тому числові значення швидкості реакцій будуть різними в залежності від того, для якого моменту чи проміжку часу ми розглядаємо зміну концентрації. Нехай є реакція
a A + bВ = dD + rR
Середню швидкість хімічної реакції можна визначити за зміною концентрації речовини А за час t2 – t1.

 (ХІ.2.1)
(ХІ.2.1)
Істинна швидкість запишеться у вигляді
 , (ХІ.2.2)
, (ХІ.2.2)
де V - об’єм, nA - кількість речовини А в момент часу t. Знак мінус береться для вихідних речовин, щоб швидкість мала позитивне значення. При визначенні швидкості за будь-яким із продуктів реакції необхідно брати знак плюс, оскільки концентрація цих речовин у часі зростає (рис. 55).
Між швидкостями, визначеними за різними речовинами, існує зв’язок:
 , (ХІ.2.3)
, (ХІ.2.3)
який витікає з такої рівності:
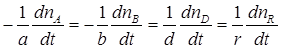 (ХІ.2.4)
(ХІ.2.4)
Якщо вимірювати об’єм у літрах, кількість речовини в молях, а час у секундах, то розмірність швидкості буде моль/л·с.
Якщо реакція протікає при сталому об’ємі, то його можна ввести під знак диференціала і визначити швидкість через зміну концентрації в одиницю часу:

 (ХІ.2.5)
(ХІ.2.5)
В основі теорії кінетики лежить фундаментальне положення Гульдберга і Вааге, згідно з яким швидкість хімічної реакції пропорційна активним масам реагентів.
Розглянемо реакцію, в якій всі реагуючі речовини знаходяться в газоподібному стані. Очевидно, що необхідною умовою, яка визначає можливість взаємодії між двома молекулами, є їх взаємне зіткнення, тобто зближення до такої віддалі, при якій електрони і атоми однієї молекули попадають у сферу дії електричних полів, що збуджуються частинками іншої молекули. Лише при таких умовах можуть відбутися ті переходи електронів і перегрупування атомів, внаслідок яких утворюються нові молекули.
Безумовно, не кожне зіткнення веде до такої взаємодії. Число зіткнень, що зазнає кожна молекула газу у звичайних умовах, дуже велике і досягає мільярдів у секунду. З цього випливає, що в реакціях, які протікають з кінечними швидкостями (а не миттєво), до взаємодії веде лише якась мала частина зіткнень. Число активних зіткнень зростає при збільшенні концентрації реагентів.
Сформулюємо тепер основний постулат хімічної кінетики, що визначає залежність швидкості реакції від концентрації реагуючих речовин. Швидкість хімічної реакції пропорційна концентраціям реагуючих речовин, взятих у деяких степенях (закон діяння мас). Наприклад, якщо реагують речовини А і В, то
 (ХІ.2.6)
(ХІ.2.6)
Коефіцієнт пропорційності k для кожної реакції при сталій температурі є величиною сталою і називається константою швидкості реакції. Вона чисельно рівна швидкості реакції в умовах, коли концентрації кожної з вихідних речовин рівні одиниці. Показники степені (n1 і n2), до яких піднесені значення концентрацій відповідних речовин (с A і с B), називається порядком реакції за відповідною речовиною. Загальний порядок рівний сумі порядків реакцій за кожною речовиною або сумі показників степенів n = n1 + n2. Раніше вважалось, що порядок реакції просто рівний стехіометричному коефіцієнту, з яким входить дана речовина в хімічну реакцію. Проте, це буває дуже рідко. Стехіометричні коефіцієнти можуть бути досить великими, в той час як порядок реакції звичайно не перевищує трьох.
Поиск по сайту: