 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.4. Необоротні реакції першого порядку
До реакцій першого порядку відносять такі, швидкість яких пов’язана з концентрацією с реагуючих речовин рівнянням
w = k· с (ХІ.4.1)
Нехай у початковий момент часу є а молей вихідної речовини А. Якщо до моменту часу t прореагувало х молей, то в суміші залишилось (а - x) молей. Тоді концентрація речовини А в момент часу t рівна
 , (ХІ.4.2)
, (ХІ.4.2)
де V - об¢єм системи.
З урахуванням (ХІ.4.1) одержуємо
 (ХІ.4.3)
(ХІ.4.3)
Після елементарних перетворень одержуємо диференціальне рівняння швидкості необоротної реакції першого порядку
 (ХІ.4.4)
(ХІ.4.4)
Розділивши змінні і проінтегрувавши рівняння, одержуємо
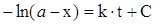 , (ХІ.4.5)
, (ХІ.4.5)
де С - константа інтегрування, яку можна знайти підставивши початкові умови (t = 0, х = 0) в (ХІ.4.5)
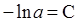 (ХІ.4.6)
(ХІ.4.6)
Підставивши в (ХІ.4.5) значення с з (ХІ.4.6) і розв’язуючи (ХІ.4.5) відносно k, одержимо
 (ХІ.4.7)
(ХІ.4.7)
 Залежність кількості прореагованої (х) і непрореагованої (а -х) речовини А від часу показана на рис. 56.
Залежність кількості прореагованої (х) і непрореагованої (а -х) речовини А від часу показана на рис. 56.
Якщо об’єм системи в ході реакції залишається сталим, то (ХІ.4.7) можна записати у іншому вигляді:
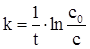 , (ХІ.4.8)
, (ХІ.4.8)
де с0 - вихідна концентрація речовини, що прореагувала, с - концентрація цієї речовини на момент часу t.
З рівнянь (ХІ.4.7), (ХІ.4.8) видно, що k має розмірність оберненого часу (t–1). Рівняння (ХІ.4.8) можна записати в експоненціальній формі:
 (ХІ.4.9)
(ХІ.4.9)
Для характеристики хімічних реакцій поряд з константою швидкості користуються періодом напіврозпаду t1/2. Він рівний проміжку часу, протягом якого прореагує половина вихідної кількості речовини. Приймаючи, що с = с 0/2, можна записати таке рівняння:
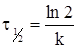 (ХІ.4.10)
(ХІ.4.10)
З цього випливає, що період напіврозпаду реакції першого порядку обернено пропорційний константі швидкості і не залежить від кількості вихідної речовини. Це пояснюється тим, що перетворення молекул у випадку простих молекулярних реакцій не залежить від того, чи присутні інші речовини. Величина, обернена до константи швидкості молекулярної реакції (простої реакції першого порядку), характеризує середню тривалість життя окремих молекул. Прикладами реакцій першого порядку є:
розклад диметилового ефіру
СН3ОСН3 ® СН4 + Н2 + СО;
розклад оксиду азоту (V)
2N2О5 ® 2N2О4 + О2 .
Ця реакція протікає постадійно:
N2О5 ® N2 О3 + О2 (повільна)
N2О3 ® NО + NО2 (швидка)
NО + N2О5 ® 3 NО2 (швидка)
4NО2 ® 2N2О4 (швидка)
 2N2О5 ® 2N2О4 + О2
2N2О5 ® 2N2О4 + О2
Перша, повільна, мономолекулярна стадія визначає перший порядок реакції, що спостерігається.
Прикладом реакції першого порядку в розчині - гідролітичний розпад тростинного цукру у воді на глюкозу і фруктозу:
С12Н22О11 + Н2О ® С6Н12О6 + С6Н12О6
Реакція гідролізу цукру за своїм механізмом бімолекулярна. Згідно з законом діяння мас для такої реакції: w = k×с(цук.)×с(Н2О); але в розбавленому розчині кількість води, що йде на гідроліз, настільки незначна, що її концентрацію можна вважати сталою. Тоді
 Н2О
Н2О 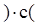 цук.
цук.  цук.
цук.  (ХІ.4.11)
(ХІ.4.11)
Це відповідає рівнянню першого порядку. Реакції такого типу називаються псевдомолекулярними.
Поиск по сайту: