 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.12. Теорія активного комплексу або перехідного стану
Початок розвитку цієї теорії, яку ще називають теорією абсолютних швидкостей реакцій, поклали роботи Ейрінга і Поляні (1935), в яких використані основні уявлення теорії активних зіткнень про рух молекул, про їх зіткнення і про необхідність подолання енергетичного бар’єру в ході активних зіткнень. Проте теорія активного комплексу більш детально, в порівнянні з теорією зіткнень, розглядає процес хімічного перетворення і приділяє особливу увагу тому стану реагуючих молекул, який є проміжним у ході його перетворення.
Основне положення теорії: всяка хімічна реакція протікає через утворення деякого активного комплексу, який потім розпадається на продукти даної реакції.
Так, наприклад, реакцію АВ + СD = АС + ВD можна представити таким чином:

Спочатку існують молекули АВ і СD, розташовані достатньо далеко одна від одної. При цьому взаємодіють атоми, що входять до складу однієї і тієї ж молекули. Ці зв’язки достатньо міцні. Після зближення цих молекули виникає зв’язок між атомами, що входять до складу різних молекул, а колишні зв’язки стають більш слабкими. В подальшому старі зв’язки іще більш слабшають і розриваються, а нові, навпаки, міцніють. Внаслідок цього відбувається перегрупування атомів, і замість вихідних молекул утворюються молекули продуктів. Можна уявити собі, що в ході цієї реакції молекули, що реагують, утворюють деякий малостійкий комплекс атомів А, В, С і D, який потім розпадається на молекули продуктів. Це комплекс, в якому старі зв’язки між атомами ще не повністю розірвались, а нові ще не цілком утворились. На утворення активного комплексу необхідна енергія, що рівна енергії активації. Той факт, що експериментальні значення енергії активації хімічних реакцій завжди значно менші енергії дисоціації відповідних речовин, підтверджує уявлення про те, що протягом реакції не відбувається повного розривання старих зв’язків.
Структура перехідного комплексу має важливе значення для пояснення швидкості будь-якої реакції, оскільки константа швидкості залежить від константи рівноваги К¹ процесу утворення активного комплексу, наприклад:
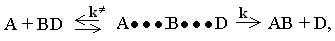
де А···В···D - перехідний активний комплекс. Ця залежність витікає з того, що протікання реакції суттєво не порушує статистичного рівноважного розподілу молекул за Максвеллом-Больцманом. Мірою відносної статистичної стійкості реагуючих речовин і перехідного стану є константа К¹. Від звичайної константи рівноваги вона відрізняється величиною і розмірністю. Не слід ототожнювати активний комплекс з проміжними хімічними сполуками. Активний комплекс є лише перехідним станом реагуючих частинок у момент зіткнень. Час його існування мізерний; він коротший за час зіткнень; конфігурація перехідного комплексу відповідає максимуму потенціальної енергії (нестійкість системи).
Утворення активного комплексу в кожній реакції, як вже відмічалось вище, вимагає певної енергії активації, розпад його відбувається самочинно. Тому швидкість вище зазначеної реакції рівна числу активних комплексів, що проходять в одиницю часу через енергетичний бар’єр у напрямку ходу реакції, тобто вона рівна так званій лінійній концентрації с* активного комплексу вздовж шляху реакції, помноженій на середню швидкість  його руху по цьому шляху. Оскільки швидкість реакції підкоряється закону дії мас, то можна записати
його руху по цьому шляху. Оскільки швидкість реакції підкоряється закону дії мас, то можна записати
 , (ХІ.12.1)
, (ХІ.12.1)
де χ - трансмісійний коефіцієнт, який визначає частку активних комплексів, що перетворюються в кінцеві речовини (для звичайних реакцій χ ≈ 1); с1 і с2 - концентрації А і ВD.
З рівняння (ХІ.12.1) одержуємо
 (ХІ.12.2)
(ХІ.12.2)
В теорії перехідного стану допускається, що вихідні речовини знаходяться в статистичній рівновазі з активним комплексом. Тому можна записати:
 (ХІ.12.3)
(ХІ.12.3)
Таким чином:
 (ХІ.12.4)
(ХІ.12.4)
Швидкість  і коефіцієнт χ розраховують за рівнянням кінетичної теорії газів і квантової теорії; константа рівноваги визначається методом статистичної термодинаміки на підставі спектроскопічних даних. Після виконання складних розрахунків рівняння (ХІ.12.4) набуває кінцевого вигляду:
і коефіцієнт χ розраховують за рівнянням кінетичної теорії газів і квантової теорії; константа рівноваги визначається методом статистичної термодинаміки на підставі спектроскопічних даних. Після виконання складних розрахунків рівняння (ХІ.12.4) набуває кінцевого вигляду:
 , (ХІ.12.5)
, (ХІ.12.5)
де h - стала Планка, N0 - число Авогадро, К¹ - константа рівноваги вихідних речовин з активним комплексом. Множник  має розмірність с -1 і представляє собою неначе частоту розпаду перехідного комплексу при даній температурі. Він однаковий для реакцій і залежить лише від температури.
має розмірність с -1 і представляє собою неначе частоту розпаду перехідного комплексу при даній температурі. Він однаковий для реакцій і залежить лише від температури.
Константу швидкості можливо виразити через термодинамічні характеристики перехідного стану, враховуючи, що термодинамічна константа рівноваги К (при р = const) зв’язана зі зміною ентропії ΔS¹ і ентальпією ΔH¹ при утворенні активного комплексу. Відомо, що
 (ХІ.12.6)
(ХІ.12.6)
або
 . (ХІ.12.7)
. (ХІ.12.7)
Оскільки
 , (ХІ.12.8)
, (ХІ.12.8)
то рівняння для констант рівноваги набуває вигляду:
 (ХІ.12.9)
(ХІ.12.9)
Об’єднавши (ХІ.12.5) і (ХІ.12.9), одержуємо рівняння для константи швидкості
 (ХІ.12.10)
(ХІ.12.10)
Співставляючи рівняння (ХІ.12.10) з (ХІ.11.13), приходимо до висновку, що, якщо ΔН0≠ = ентальпія активації, то
 (ХІ.12.11)
(ХІ.12.11)
Таким чином стеричний фактор ρ у теорії активних зіткнень визначається зміною ентропії при утворенні активного комплексу.
Можливість обчислення ΔS≠, а значить, і передекспонціального множника в рівнянні (ХІ.11.13) надає особливу цінність теорії перехідного стану.
Поиск по сайту: