 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.16. Ланцюгові і фотохімічні реакції
Багато гомогенних реакцій окиснення, галогенування, розщеплення, полімеризації та ін. мають такі особливості, які не можуть бути пояснені на підставі кінетичних закономірностей, що розглянуті вище. Ці реакції не підкоряються рівнянням першого, другого і вищих порядків. Характерно те, що вони надзвичайно чутливі до слідів домішок; швидкість їх в значній мірі залежить від форми реакційної посудини, наприклад, зменшується в міру зменшення діаметру посудини. Часто такі реакції починаються не одразу, а після деякого індуктивного періоду, що передує помітній зміні концентрації реагуючих речовин. Всі ці особливості добре пояснюються ланцюговим механізмом реакції. Сутність механізму полягає в тому, що активна молекула, реагуючи, породжує нову активну молекулу або реакційноздатну частинку (валентно-ненасичені вільні атоми чи радикали). Процес зникнення і регенерації кожної активної частинки в подальшому циклічно повторюється багато разів і утворює ланцюг перетворень, що здійснюється частково послідовно, а частково паралельно.
Прикладом ланцюгової реакції може служити добре вивчена реакція при відповідному опроміненні
Н2 + Сl2 = 2НСl
Якщо, хоч би дуже короткочасно піддавати суміш Н2 і Сl2 інтенсивному освітленню, то відбувається швидке утворення хлористого водню. Пояснення особливостей кінетики цієї реакції полягає в наступному. Спочатку фотон поглинається молекулою хлору, зв’язок Сl-Сl розривається і утворюються вільні атоми хлору:
Сl2 + hν → 2Сl˙
Реакції, в яких виникають первинні активні частинки, називають реакціями зародження ланцюга. Валентно-ненасичені атоми хлору дають початок росту ланцюга перетворень, який вимагає невеликої енергії активації:
Сl˙ + Н2 → НСl + Н˙;
Н˙ + Сl2 → НСl + Сl˙
Внаслідок цих реакцій знов утворюються активні частинки. Стадії, що повторюються називаються ланками ланцюга. Число ланок ланцюга в реакції синтезу хлористого водню досягає 100 тисяч. Нарешті, є реакції, що називаються обривом ланцюга, що є причиною зникнення активних частинок:
2Сl˙ → Сl2; 2Н˙ → Н2.
 Активні частинки можуть з’являтися також при термічній дисоціації, при електричному розряді, при додаванні до реакційної суміші так званих ініціаторів (малостійких речовин, що легко розпадаються з утворенням радикалів).
Активні частинки можуть з’являтися також при термічній дисоціації, при електричному розряді, при додаванні до реакційної суміші так званих ініціаторів (малостійких речовин, що легко розпадаються з утворенням радикалів).
Для прикладу, що розглянутий вище, кожна активна частинка дає початок одного ланцюга (стаціонарні нерозгалужені ланцюги).
Проте в багатьох випадках кожна активна молекула або частинка породжує не одну, а дві і більше активних молекул або частинки, тобто ланцюг розгалужується.
Схема ланцюгової реакції, що розгалужується, зображена на рис. 63. Прикладом такої реакції може служити реакція розпаду атомного ядра або реакція розкладу озону, яка протікає за схемою

і т. д.
Тут О2* − збуджена молекула кисню.
 Ланцюгові реакції окиснення і спалахування протікають досить своєрідно. Н.Н. Семенов і С. Гіншельвуд вперше помітили, що реакції такого типу можливі, якщо зовнішній тиск не перевищує деякої верхньої межі. Наприклад, світіння фосфору, що викликається його окисненням, припиняється при заміні повітря киснем при атмосферному тиску, але відновлюється при зменшенні тиску до 59660 − 33780 Па. Стійкі при атмосферному тиску суміші РН3+О2 або SіН4+О2 самовільно вибухають при зменшенні тиску. Проте для такого типу реакцій існує також і нижня межа тисків, при переході через яку реакції припиняються. Залежність швидкості таких реакцій від тиску можна зобразити графічно (рис. 64).
Ланцюгові реакції окиснення і спалахування протікають досить своєрідно. Н.Н. Семенов і С. Гіншельвуд вперше помітили, що реакції такого типу можливі, якщо зовнішній тиск не перевищує деякої верхньої межі. Наприклад, світіння фосфору, що викликається його окисненням, припиняється при заміні повітря киснем при атмосферному тиску, але відновлюється при зменшенні тиску до 59660 − 33780 Па. Стійкі при атмосферному тиску суміші РН3+О2 або SіН4+О2 самовільно вибухають при зменшенні тиску. Проте для такого типу реакцій існує також і нижня межа тисків, при переході через яку реакції припиняються. Залежність швидкості таких реакцій від тиску можна зобразити графічно (рис. 64).
 Область АВ відповідає повільній реакції нижче нижньої межі вибуховості В. Потім взаємодія швидко зростає, і реакція протікає самоприскорюючись. Після досягнення верхньої межі вибуховості С реакція настільки ж швидко сповільнюється і потім її швидкість повільно зростає разом із зростанням тиску до наступного теплового вибуху в точці D.
Область АВ відповідає повільній реакції нижче нижньої межі вибуховості В. Потім взаємодія швидко зростає, і реакція протікає самоприскорюючись. Після досягнення верхньої межі вибуховості С реакція настільки ж швидко сповільнюється і потім її швидкість повільно зростає разом із зростанням тиску до наступного теплового вибуху в точці D.
Залежність обох меж тиску від температури зображено на рис. 65. Гілка а b відповідає нижчій межі, а гілка а с − верхній. У заштрихованій області реакція досягає спалахування або вибуху, а поза нею протікає повільно і стаціонарно.
До фотохімічних реакцій відносять всі реакції, в яких енергія, що необхідна для їх протікання або збудження, підводиться у формі електромагнітних коливань різної частоти. Світло, що падає на речовину, може поглинатись або розсіюватись нею. Поглинання світла залежить як від довжини хвилі падаючого світла, так і від природи речовини, що поглинає. Хімічну дію спричиняє лише світло, що поглинається. Фотохімічні перетворення можуть відбуватись у газах, рідинах і твердих тілах. Найбільш важливе значення мають реакції фотосинтезу, що протікають у рослинах під дією сонячного світла. Це багатостадійний процес, сумарне рівняння якого можна записати у вигляді
сон. світ.
 6n СО2 + 5n Н2О (С6Н10О5)n + 6n О2
6n СО2 + 5n Н2О (С6Н10О5)n + 6n О2
хлорофіл
До фотохімічних відносять також реакції ізомеризації, фотохімічного розкладу, ланцюгові реакції, реакції що лежать в основі фотографічного процесу та ін.
Кожна фотохімічна реакція ділиться на дві стадії: первинну стадію, що викликається дією світла, і вторинну “темнову” стадію, в якій світло не бере участі. Зазвичай ці стадії швидко слідують одна за другою і не завжди можуть бути розділені. Цим пояснюється уявне порушення простих закономірностей, яким підкоряються первинні фотохімічні реакції. Первинний фотохімічний процес полягає в поглинанні молекулою кванта світла, що може привести до дисоціації її на атоми або активації:
hν hν
АВ → А + В або АВ → АВ≠
Після цього протікає вторинний процес хімічної взаємодії атомів, радикалів чи збуджених молекул.
Залежність між кількістю речовини, що прореагувала в первинному процесі, і кількістю поглиненої енергії підкоряється закону фотохімічної еквівалентності Штарка-Ейнштейна: кожна молекула, що реагує під дією світла, поглинає один квант світлової енергії або один поглинутий квант енергії викликає єдиний первинний хімічний процес.
Таким чином, кількість енергії, що поглинається одним молем речовини
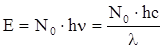 , (ХІ.16.1)
, (ХІ.16.1)
де N0 − число Авогадро; ν − частота коливань; λ − довжина хвилі; с − швидкість світла.
При дослідній перевірці закону фотохімічної еквівалентності часто виявляється розбіжність з теорією, а саме, кількість речовини, що прореагувала, виявляється більшою або меншою кількості поглинутої енергії. Ці розбіжності пояснюються протіканням вторинних процесів і характеризуються величиною квантового виходу. Квантовим виходом фотохімічної реакції γ називають відношення числа частинок N, що піддаються хімічному перетворенню внаслідок первинних і вторинних процесів, до числа nhν квантів поглиненої енергії
 . (ХІ.16.2)
. (ХІ.16.2)
Фотохімічні перетворення, що здійснюються в одну стадію, мають γ=1. Якщо внаслідок первинного процесу утворюються стабільні радикали, що викликають вторинну ланцюгову реакцію, то γ>>1. Якщо ж при первинному розпаді утворюються нестійкі молекули чи радикали, які далі розкладаються чи рекомбінуються, то γ<<1.
Якщо в системі є речовина, яка повністю поглинає світло, що падає, то швидкість фотохімічної реакції повинна визначатись лише кількістю поглиненої енергії або інтенсивністю світла, що падає І0
 , (ХІ.16.3)
, (ХІ.16.3)
тобто швидкість реакції не залежить від концентрації реагуючої речовини. У випадку неповного поглинання враховується різниця між поглинутим монохроматичним промінням і промінням, що пройшло через шар речовини. За законом Ламберта-Бера інтенсивність світлового потоку І0, після проходження шару речовини товщиною ℓ, послаблюється і рівна
І = І0 × е − α×с×ℓ, (ХІ.16.4)
де α − коефіцієнт поглинання, що залежить від природи речовини і довжини хвилі; с − концентрація. Тоді швидкість первинної реакції
 (ХІ.16.5)
(ХІ.16.5)
залежить від концентрації.
Всі ці закономірності справедливі лише тоді, коли вторинні реакції, в порівнянні з первинними, протікають дуже швидко. При співмірності швидкостей виникає складна залежність сумарної швидкості від концентрації, і кінетичне рівняння буде визначатись характером і послідовністю проміжних ланок.
Фотохімічні реакції відрізняються малими температурними коефіцієнтами швидкості. Якщо температурні коефіцієнти звичайних реакцій лежать у межах від 2 до 4, то для фотохімічних реакцій вони близькі до одиниці і рідко перевищують 1,5.
Поиск по сайту: