 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тангенциальная составляющая ускорения 14 страница
Существуют вещества (сахар, соль), которые увеличивают поверхностное натяжение жидкости благодаря тому, что их молекулы взаимодействуют с молекулами жидкости сильнее, чем молекулы жидкости между собой. Например, если посолить мыльный раствор, то в поверхностный слой жидкости выталкивается молекул мыла больше, чем в пресной воде. В мыловаренной технике мыло «высаливается» этим способом из раствора.

§ 67. Смачивание
Из практики известно, что капля воды растекается на стекле и принимает форму, изображенную на рис. 98, в то время как ртуть на той же поверхности превращается в несколько сплюснутую каплю (рис. 99). В первом случае говорят, что жидкость смачивает твердую поверхность, во втором — не смачивает ее. Смачивание зависит от характера сил, действующих между молекулами поверхностных слоев соприкасающихся сред. Для смачивающей жидкости силы притяжения между молекулами жидкости и твердого тела больше, чем между молекулами самой жидкости, и жидкость стремится увеличить поверхность соприкосновения с твердым телом. Для несмачивающей жидкости силы притяжения между молекулами жидкости и твердого тела меньше, чем между молекулами жидкости, и жидкость стремится уменьшить поверхность своего соприкосновения с твердым телом.
К линии соприкосновения трех сред (точка О есть ее пересечение с плоскостью чертежа) приложены три силы поверхностного натяжения, которые направлены по касательной внутрь поверхности соприкосновения соответствующих двух сред (рис. 98 и 99). Эти силы, отнесенные к единице длины линии соприкосновения, равны соответствующим поверхностным натяжениям s12, s13, s23. Угол q между касательными к поверхности жидкости и твердого тела называется краевым углом. Условием равновесия капли (рис. 98) является равенство нулю суммы проекций сил поверхностного натяжения на направление касательной к поверхности твердого тела, т. е.

откуда
 (67.1)
(67.1)
Из условия (67.1) вытекает, что краевой угол может быть острым или тупым в зависимости от значений s13 и s12. Если s13 > s12, то cos q > 0 и угол q— острый (рис. 98), т. е. жидкость смачивает твердую поверхность. Если s13 < s12, то cos q < 0 и угол q — тупой (рис. 99), т. е. жидкость не смачивает твердую поверхность. Краевой угол удовлетворяет условию (67.1), если
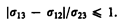 (67.2)
(67.2)
Если условие (67.2) не выполняется, то капля жидкости 2 ни при каких значениях q не может находиться в равновесии. Если s13 > s12 + s23, то жидкость растекается по поверхности твердого тела, покрывая его тонкой пленкой (например, керосин на поверхности стекла), —имеет место полное смачивание (в данном случае q = 0). Если s12 > s13 + s23, то жидкость стягивается в шаровую каплю, в пределе имея с ней лишь одну точку соприкосновения (например, капля воды на поверхности парафина), — имеет место полное несмачивание (в данном случае q = p).
Смачивание и несмачивание являются понятиями относительными, т. е. жидкость, смачивающая одну твердую поверхность, не смачивает другую. Например, вода смачивает стекло, но не смачивает парафин; ртуть не смачивает стекло, но смачивает чистые поверхности металлов.

Явления смачивания и несмачивания имеют большое значение в технике. Например, в методе флотационного обогащения руды (отделение руды от пустой породы) ее, мелко раздробленную, взбалтывают в жидкости, смачивающей пустую породу и не смачивающей руду. Через эту смесь продувается воздух, а затем она отстаивается. При этом смоченные жидкостью частицы породы опускаются на дно, а крупинки минералов «прилипают» к пузырькам воздуха и всплывают на поверхность жидкости. При механической обработке металлов их смачивают специальными жидкостями, что облегчает и ускоряет обработку.
§ 68. Давление под искривленной поверхностью жидкости
Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное (добавочное) давление. Это давление, обусловленное силами поверхностного натяжения, для выпуклой поверхности положительно, а для вогнутой поверхности — отрицательно.
Для расчета избыточного давления предположим, что свободная поверхность жидкости имеет форму сферы радиуса R, от которой мысленно отсечен шаровой сегмент, опирающийся на окружность радиуса r=R sin a (рис. 100). На каждый бесконечно малый элемент длины D l этого контура действует сила поверхностного натяжения D F = s D l, касательная к поверхности сферы. Разложив DF на два компонента (DF1 и DF2), видим, что геометрическая сумма сил DF2 равна нулю, так как эти силы на противоположных сторонах контура направлены в обратные стороны и взаимно уравновешиваются. Поэтому равнодействующая сил поверхностного натяжения, действующих на вырезанный сегмент, направлена перпендикулярно плоскости сечения внутрь жидкости и равна алгебраической сумме составляющих DF1:

Разделив эту силу на площадь основания сегмента p r 2, вычислим избыточное давление на жидкость, создаваемое силами поверхностного натяжения и обусловленное кривизной поверхности:
 (68.1)
(68.1)
Если поверхность жидкости вогнутая, то можно доказать, что результирующая сила поверхностного натяжения направлена из жидкости и равна
 (68.2)
(68.2)
Следовательно, давление внутри жидкости под вогнутой поверхностью меньше, чем в газе, на величину D p.

Формулы (68.1) и (68.2) являются частным случаем формулы Лапласа,* определяющей избыточное давление для произвольной поверхности жидкости двоякой кривизны:
 (68.3)
(68.3)
где R 1 и R 2 — радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в дайной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
*П. Лаплас (1749—1827) — французский ученый.
Для сферической искривленной поверхности (R 1 =R 2 =R) выражение (68.3) переходит в (68.1), для цилиндрической (R 1 =R и R 2 = ¥) — избыточное давление

В случае плоской поверхности (R 1 =R 2 = ¥) силы поверхностного натяжения избыточного давления не создают.
§ 69. Капиллярные явления
Если поместить узкую трубку (капилляр) одним концом в жидкость, налитую в широкий сосуд, то вследствие смачивания или несмачивания жидкостью стенок капилляра кривизна поверхности жидкости в капилляре становится значительной. Если жидкость смачивает материал трубки, то внутри ее поверхность жидкости — мениск — имеет вогнутую форму, если не смачивает — выпуклую (рис. 101).
Под вогнутой поверхностью жидкости появится отрицательное избыточное давление, определяемое по формуле (68.2). Наличие этого давления приводит к тому, что жидкость в капилляре поднимается, таккак под плоской поверхностью жидкости в широком сосуде избыточного давления нет. Если же жидкость не смачивает стенки капилляра, то положительное избыточное давление приведет к опусканию жидкости в капилляре. Явление изменения высоты уровня жидкости в капиллярах называется капиллярностью. Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление) rgh уравновешивается избыточным давлением D p, т. е.

где r — плотность жидкости, g — ускорение свободного падения.
Если r — радиус капилляра, q — краевой угол, то из рис. 101 следует, что (2 s cos q) /r = rgh, откуда
 (69.1)
(69.1)
В соответствии с тем, что смачивающая жидкость по капилляру поднимается, а несмачивающая—опускается, из формулы (69.1) при q<p/ 2 (cos q >0) получим положительные значения h, а при q>p/ 2 (cos q <0) — отрицательные. Из выражения (69.1) видно также, что высота поднятия (опускания) жидкости в капилляре обратно пропорциональна его радиусу. В тонких капиллярах жидкость поднимается достаточно высоко. Так, при полном смачивании (q =0) вода (r =1000 кг/м3, s = 0,073 Н/м) в капилляре диаметром 10мкм поднимается на высоту h»3 м.

Капиллярные явления играют большую роль в природа и технике. Например, влагообмен в почве и в растениях осуществляется за счет поднятия воды по тончайшим капиллярам. На капиллярности основано действие фитилей, впитывание влаги бетоном и т. д.
§ 70. Твердые тела. Моно- и поликристаллы
Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая, как показали рентгенографические исследования немецкого физика-теоретика М. Лауэ (1879—1960), является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного типа может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл. Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. 102), т. е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.

.
§ 71. Типы кристаллических твердых тел
Существует два признака для классификации кристаллов: 1) кристаллографический; 2) физический (природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними).
1. Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
Кристаллическая решетка может обладать различными видами симметрии. Симметрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853—1919), присущи 230 комбинаций элементов симметрии, или 230 различных пространственных групп.
С переносной симметрией в трехмерном пространстве связывают понятие трехмерной периодической структуры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристаллографом О. Бравэ (1811—1863). Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл. 3. Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами a, b и g между ребрами (табл. 3). Величины а, b и с и a, b и g называются параметрами элементарной ячейки и однозначно ее определяют.
2. Физический признак кристаллов. В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: ионные, атомные, металлические, молекулярные.
Ионные кристаллы. В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (NaCl, CsCl, КВr и т. д.), а также оксидов различных элементов (MgO, СаО и т. д.). Структуры решеток двух наиболее характерных ионных кристаллов — NaCl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na+, в узлах другой — ионы Cl–) и CsCl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки находится ион) — показаны на рис. 103. Силы взаимодействия между ионами являются в основном электростатическими (кулоновскими). Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называется ионной (или гетерополярной). В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собойкак бы одну гигантскую молекулу.

Таблица 3

Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями квантово-механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются алмаз и графит (два различных состояния углерода), некоторые неорганические соединения (ZnS, ВеО и т. д.), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. 104, где каждый атом углерода окружен четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдров.
Валентные связи осуществляются парами электронов, движущихся по орбитам, охватывающим оба атома, и носят направленный характер: ковалентные силы направлены от центрального атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдвигать отдельные участки кристалла, поэтому алмаз является прочным соединением.
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаотически, подобно молекулам газа, движутся «свободные» электроны, наличие которых обеспечивает хорошую электропроводность металлов. Так как металлическая связь не имеет направленного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию высокого порядка. Действительно, большинство металлов имеют кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрированную (Сu, Ag, Pt, Au) решетки. Чаще всего металлы встречаются в виде поликристаллов.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эта силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д.), инертные газы (Ne, Аr, Кr, Хе) и газы СО2, О2, N2 в твердом состоянии, лед, а также кристаллы брома Вr2, иода I2. Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером может служить графит (гексагональная решетка). Решетка графита (рис. 105) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника. Плоские слои связаны друг с другом ван-дер-ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным», коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя. Таким образом, в данном случае осуществляются три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван-дер-ваальсова — между слоями. Этим объясняется мягкость графита, так как его слон могут скользить друг относительно друга.
Различие в строении кристаллических решеток двух разновидностей углерода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т. д.

Расположение атомов в кристаллах характеризуется также координационным числом — числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. 106, а, б). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата. Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6, т. е. чем плотнее упаковка, тем больше координационное число.
Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. 106, б. Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их белыми кружками (рис. 107). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. 107 соответственно черными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В — если над красными кружками, слоем С — если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС..., в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ... — гексагональная плотноупакованная структура (рис. 108); 2) трехслойная упаковка АВСАВС... — кубическая гранецентрированная структура (рис. 109). В обеих решетках координационное число равно 12 и плотность упаковки одинакова — атомы занимают 74% общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. 104) равно 4.
Кроме двух- и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАСАВСВАС... — шестислойная упаковка. Существует модификация карбида SiC с периодом повторяемости 6, 15 и 243 слоя.
Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. На рис. 110 приведено модельное изображение кристалла поваренной соли. Крупные ионы хлора (r =181 пм) образуют плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (r =98 пм). Каждый ион Na окружен шестью ионами Сl и, наоборот, каждый ион Cl — шестью ионами Na.

§ 72. Дефекты в кристаллах
Рассмотренные в § 71 идеальные кристаллические структуры существуют лишь в очень малых объемах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности.
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: 1) вакансии — отсутствие атома в узле кристаллической решетки (рис. 111, a); 2) междоузельный атом — атом, внедрившийся в междоузельное пространство (рис. 111, б); 3) примесный атом — атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. 111, в), либо внедрившийся в междоузельное пространство (примесь внедрения, рис. 111, б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, — в этом состоит их характерная особенность.
Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокациями. Дислокации — линейные дефекты, нарушающие правильное чередование атомных плоскостей.

Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. 112, а). В случае винтовой дислокации (рис. 112, б) ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности.
Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102 — 103 см–2, для деформированных кристаллов — 1010 — 1012 см–2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления — в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации.
Наличие дефектов в кристаллической структуре влияет на свойства кристаллов, анализ которых проведем ниже.
§ 73. Теплоемкость твердых тел
В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы (см. § 50), обладает энергией kT.
Внутренняя энергия моля твердого тела

где NA — постоянная Авогадро; NAk=R (R — молярная газовая постоянная). Молярная теплоемкость твердого тела
 (73.1)
(73.1)
т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом

состоянии одинакова (равна 3 R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785—1838) и Л. Пти (1791—1820) и носит название закона Дюлонга и Пти.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n — число атомов в молекуле (для NaCl число частиц в моле равно 2 NA, так, в одном моле NaCl содержится NA атомов Na и NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений

т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
Как показывают опытные данные (табл. 4), для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов (см. § 53), опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. 113). Вблизи нуля кельвин теплоемкость тел пропорциональна Т 3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3 R при1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
Поиск по сайту: