 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Коррозионно-стойкие стали
Коррозия –это термин, используемый для обозначения широкого класса видов нежелательного повреждения металла в результате его химического или электрохимического взаимодействия с окружающей средой.
Под повреждением понимается образование различных коррозионных дефектов (каверн, язв, питтингов, трещин), утонение толщины стенок, деградация свойств и строения (изменение структуры связано в основном с субструктурой матрицы металла) материала несущих элементов конструкции в процессе эксплуатации, что ведет к потере или снижению её работоспособности. Коррозия многообразна в своём проявлении и ведёт в конечном итоге к разрушению материалов (в первую очередь за счёт локальных видов коррозии) и выходу оборудования из строя.
Коррозия является самопроизвольным процессом, вызванным термодинамической неустойчивостью металлов, т. е. стремлением к уменьшению свободной энергии в различных средах при данных внешних условиях.
Определить возможность протекания коррозии, как химического или электрохимического процесса, можно по изменению энергии Гиббса (свободной энергии):
–ΔG = z · F · E,
где F – число Фарадея; Е – разность потенциалов φK и φA, характеризующих катодную и анодную реакции, которые определяются уравнениями Нернста:

 ,
,
где 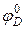 и
и  – величины стандартных электродных потенциалов деполяризатора (катода) и металла (анода) соответственно;
– величины стандартных электродных потенциалов деполяризатора (катода) и металла (анода) соответственно;  и
и  – активность соответствующих ионов на катоде и аноде.
– активность соответствующих ионов на катоде и аноде.
Величины стандартных электродных потенциалов различных металлов позволяют приближенно судить о термодинамической нестабильности металлов: чем более электроотрицателен потенциал металла, тем он активнее отдает свои электроны.
Если рассмотреть типичную реакцию окисления для металлов:
2Ме + z2O2 +zН2O → Ме(OН)2,
то ΔG (для стандартных условий) для реакций превращения в гидроксиды Мg, Cu, Аu составит соответственно 598 (φ0 = –2,363 В), 120 (φ0 = 0,520 В) и
+66 кДж/моль (φ0 = 1,692 В). Следовательно, Мg более склонен к окислению, чем Сu, окисление Аu невозможно.
По природе гетерогенных процессов взаимодействия окружающей среды с металлами эти процессы можно разделить на два основных типа:
· химическая коррозия – протекает в сухой атмосфере и чаще всего при повышенных температурах (газовая коррозия). Этот же тип коррозии металлических материалов наблюдается при взаимодействии с неэлектролитами;
· электрохимическая коррозия (ЭКХ) – самопроизвольное разрушение металлических материалов вследствие взаимодействия их с электролитически проводящей средой.
Газовая коррозия металла протекает при его взаимодействии с газами (О2, N2, СО2, SO2, H2 и др.) при повышенных температурах (закалка, отжиг, ковка, прокатка – технологические процессы, а также выхлопные газы ДВС и дизелей, отвод газов в металлургической и нефтехимической промышленностях).
К электрохимической коррозии относятся:
· коррозия в электролитах – кислотная, щелочная, солевая, морская и т. п.;
· почвенная – ржавление металла в грунте (подземные трубопроводы);
· структурная коррозия – разрушение связано с повышенной коррозионной активностью одного из компонентов сплава из-за его структурной неоднородности;
· электрокоррозия – разрушение металлов под действием блуждающих токов;
· контактная коррозия – интенсивное разрушение металлов, имеющих разные электродные потенциалы (например, «Медь – алюминий»);
· щелевая коррозия – усиленное разрушение в зазорах, резьбовых соединениях, между фланцами;
· коррозия под напряжением – агрессивная среда в сочетании с внешними нагрузками;
· эрозионная коррозия – разрушение металла вследствие одновременного воздействия среды и механического износа;
· кавитационная коррозия – разрушение металла при одновременном воздействии удара и агрессивной среды;
· фриттинг-коррозия – разрушение металла механическим истирающим воздействием при наличии коррозионной среды.
Электрохимическая коррозия развивается в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие неоднородности металлического материала или внешней среды. Неоднородность поверхности материалов связана с концентрационной неоднородностью сталей и сплавов (ликвацией), границами зерен, присутствием различных включений, анизотропностью свойств отдельных кристаллитов, несплошностью и различным составом поверхностных пленок, неоднородностью деформаций и напряжений в металлах.
В зависимости от характера разрушения различают коррозию равномерную, протекающую примерно с одинаковой скоростью по всей поверхности метала, помещенного в коррозионную среду, и локальную, охватывающую только некоторые участки поверхности (точечная, щелевая, межкристаллитная, избирательная – в зависимости от характера разрушаемых участков).
По механизму действия все методы борьбы с коррозией можно разделить на 2 основные группы: электрохимические (термическая обработка, легирование, пассивация, ингибирование среды, химико-термическая обработка, диффузионная металлизация, протекторная защита и т. д.), оказывающие влияние на потенциал металла или его критическое значение, и механические (лакокрасочные и пластмассовые покрытия, консервация, эмалирование и т. д.), изолирующие металл от воздействия окружающей среды созданием защитной плёнки и покрытий.
Коррозионно-стойкими (нержавеющими) называют металлы и сплавы, в которых процесс коррозии развивается с малой скоростью. Коррозионно-стойкие стали применяют для изготовления деталей машин и оборудования и конструктивных элементов, работающих в разных агрессивных средах (влажная атмосфера, морская вода, кислоты и растворы солей, щелочей, расплавы металлов и др.).
В зависимости от химического состава стали и сплавы разделяют на классы по основному составляющему элементу: хромистые, хромоникелевые, хромомарганцевые и другие, а также сплавы на основе никеля. В зависимости от структуры: ферритные, мартенситные, аустенитные.
Основной легирующий элемент в коррозионных сталях – хром с содержанием от 12–30 %. Железо и хром образуют непрерывный ряд твердых растворов, а также интерметаллид (σ -фаза). Хром с углеродом образует карбид Cr23C6,более устойчивый в сравнении с цементитом, а также карбид Cr7C3. В зависимости от соотношения углерода и хрома можно выделить три группы хромистых сталей – ферритные, не испытывающие γ «α превращение (08Х18Т, 15Х28), полуферритные, испытывающие частичное превращение γ «α (08Х13, 12Х13), и мартенситные (20Х13, 30Х13, 40Х13).

Рис. 5.4. Изменение электродного потенциала сплавов Fe–Cr
и коррозия сплавов в растворе азотной кислоты
Из рисунка 5.4 видно, что в пределах 12–13 % Cr происходит скачкообразное изменение электродного потенциала и сталь из активного состояния переходит в пассивное. Это и послужило поводом для создания группы сталей с 13 % Cr: 07Х13, 12Х13, 20Х13, 30Х13, 40Х13. Все эти стали страдают межкристаллитной коррозией. Это явление связано с образованием карбида Cr3С6. Эти карбиды располагаются на границах зерен. На образование карбидов расходуется много хрома (на 1 % С – 12 % Cr). Это неизбежно приводит к понижению концентрации хрома в зонах, прилегающих к карбидам, и зоны переходят в активное состояние. Именно по этим зонам развивается коррозия. Снижение склонности стали к МКК можно достичь введением сильных карбидообразователей (Ti, Nb, Ta), например, как в стали 07Х17Т.
Мартенситные и мартенситно-ферритные, ферритные стали обладают хорошей коррозионной стойкостью в атмосферных условиях, в слабоагрессивных средах и имеют высокие механические свойства. Ферритные стали применяют для изготовления изделий, работающих в агрессивных средах (например, в растворах азотной кислоты), для изготовления бытовых приборов, в пищевой, легкой промышленности.
В таблице 5.2 приведено основное назначение хромистых сталей.
Таблица 5.2
Поиск по сайту: