 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ББК 15.56 4 страница
Следует отметить, что «теплоемкость», как и «количество теплоты» – крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII веке. Эта теория рассматривала теплоту как особое невесомое вещество, содержащееся в телах. Оно не может быть ни создано, ни уничтожено. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты».
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией 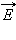 поступательного движения молекул и абсолютной температурой T:
поступательного движения молекул и абсолютной температурой T:
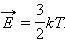
|
Внутренняя энергия 1 моля идеального газа равна произведению 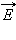 на число Авогадро NA:
на число Авогадро NA:

|
При изменении температуры на ΔT внутренняя энергия изменяется на величину
|
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
|
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать не только энергию поступательного движения, но и энергию вращательного движения молекул.

|
| Рисунок 3.10.2. Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы. |
На рис. 3.10.2 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула. Каждое независимое движение называется степенью свободы. Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные).
В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
|
где i – число степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i = 3)
|
Для газа, состоящего из двухатомных молекул (i = 5)
|
Для газа, состоящего из многоатомных молекул (i = 6)
|
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле.
Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна:
| U = 3NAkT = 3RT. |
Поэтому молярная теплоемкость вещества в твердом состоянии равна:
|
Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии.
Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением.
Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений.
3.11. Тепловые двигатели. Термодинамические циклы. Цикл Карно window.top.document.title = "3.11. Тепловые двигатели. Термодинамические циклы. Цикл Карно";
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Как следует из первого закона термодинамики, полученное газом количество теплоты Q полностью превращается в работу A при изотермическом процессе, при котором внутренняя энергия остается неизменной (ΔU = 0):
| A = Q. |
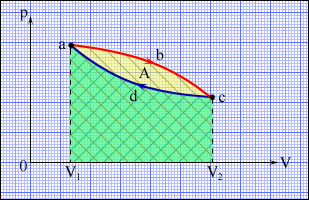
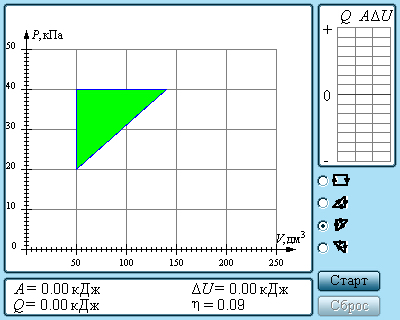
Но такой однократный акт преобразования теплоты в работу не представляет интереса для техники. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние. Круговые процессы изображаются на диаграмме (p, V) газообразного рабочего тела с помощью замкнутых кривых (рис. 3.11.1). При расширении газ совершает положительную работу A1, равную площади под кривой abc, при сжатии газ совершает отрицательную работу A2, равную по модулю площади под кривой cda. Полная работа за цикл A = A1 + A2 на диаграмме (p, V) равна площади цикла. Работа A положительна, если цикл обходится по часовой стрелке, и A отрицательна, если цикл обходится в противоположном направлении.
|
| Рисунок 3.11.1. Круговой процесс на диаграмме (p, V). abc – кривая расширения, cda – кривая сжатия. Работа A в круговом процессе равна площади фигуры abcd. |
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0. Полное количество теплоты Q, полученное рабочим телом за цикл, равно
| Q = Q1 + Q2 = Q1 – |Q2|. |
При обходе цикла рабочее тело возвращается в первоначальное состояние, следовательно, изменение его внутренней энергии равно нулю (ΔU = 0). Согласно первому закону термодинамики,
| ΔU = Q – A = 0. |
Отсюда следует:
| A = Q = Q1 – |Q2|. |
Работа A, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты Q. Отношение работы A к количеству теплоты Q1, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действия η тепловой машины:
|
|
| Модель. Термодинамические циклы. |
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1). Энергетическая схема тепловой машины изображена на рис. 3.11.2.

|
| Рисунок 3.11.2. Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело, совершающее круговой процесс. Q1 > 0, A > 0, Q2 < 0; T1 > T2. |
В применяемых в технике двигателях используются различные круговые процессы. На рис. 3.11.3 изображены циклы, используемые в бензиновом карбюраторном двигателе и в дизельном двигателе. В обоих случаях рабочим телом является смесь паров бензина или дизельного топлива с воздухом. Цикл карбюраторного двигателя внутреннего сгорания состоит из двух изохор (1–2, 3–4) и двух адиабат (2–3, 4–1). Дизельный двигатель внутреннего сгорания работает по циклу, состоящему из двух адиабат (1–2, 3–4), одной изобары (2–3) и одной изохоры (4–1). Реальный коэффициент полезного действия у карбюраторного двигателя порядка 30%, у дизельного двигателя – порядка 40 %.

|
| Рисунок 3.11.3. Циклы карбюраторного двигателя внутреннего сгорания (1) и дизельного двигателя (2). |
В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат. Этот круговой процесс сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно (рис. 3.11.4).

|
| Рисунок 3.11.4. Цикл Карно. |
Цикл Карно совершает газ, находящийся в цилиндре под поршнем. На изотермическом участке (1–2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T1. Газ изотермически расширяется, совершая работу A12, при этом к газу подводится некоторое количество теплоты Q1 = A12. Далее на адиабатическом участке (2–3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A23 > 0. Температура газа при адиабатическом расширении падает до значения T2. На следующем изотермическом участке (3–4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T2 < T1. Происходит процесс изотермического сжатия. Газ совершает работу A34 < 0 и отдает тепло Q2 < 0, равное произведенной работе A34. Внутренняя энергия газа не изменяется. Наконец, на последнем участке адиабатического сжатия газ вновь помещается в адиабатическую оболочку. При сжатии температура газа повышается до значения T1, газ совершает работу A41 < 0. Полная работа A, совершаемая газом за цикл, равна сумме работ на отдельных участках:
| A = A12 + A23 + A34 + A41. |
На диаграмме (p, V) эта работа равна площади цикла.
Как следует из первого закона термодинамики, работа газа при адиабатическом расширении (или сжатии) равна убыли ΔU его внутренней энергии. Для 1 моля газа
| A = –ΔU = –CV(T2 – T1), |
где T1 и T2 – начальная и конечная температуры газа.
Отсюда следует, что работы, совершенные газом на двух адиабатических участках цикла Карно, одинаковы по модулю и противоположны по знакам
| A23 = –A41. |
По определению, коэффициент полезного действия η цикла Карно есть
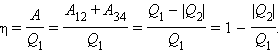
|
С. Карно выразил коэффициент полезного действия цикла через температуры нагревателя T1 и холодильника T2:
|
Цикл Карно замечателен тем, что на всех его участках отсутствует соприкосновение тел с различными температурами. Любое состояние рабочего тела (газа) на цикле является квазиравновесным, т. е. бесконечно близким к состоянию теплового равновесия с окружающими телами (тепловыми резервуарами или термостатами). Цикл Карно исключает теплообмен при конечной разности температур рабочего тела и окружающей среды (термостатов), когда тепло может передаваться без совершения работы. Поэтому цикл Карно – наиболее эффективный круговой процесс из всех возможных при заданных температурах нагревателя и холодильника:
|

|
| Модель. Цикл Карно. |
Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. Обход цикла по часовой стрелке соответствует тепловому двигателю, когда полученное рабочим телом тепло частично превращается в полезную работу. Обход против часовой стрелки соответствует холодильной машине, когда некоторое количество теплоты отбирается от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. Поэтому идеальное устройство, работающее по циклу Карно, называют обратимой тепловой машиной.
В реальных холодильных машинах используются различные циклические процессы. Все холодильные циклы на диаграмме (p, V) обходятся против часовой стрелки. Энергетическая схема холодильной машины представлена на рис. 3.11.5.

|
| Рисунок 3.11.5. Энергетическая схема холодильной машины. Q1 < 0, A < 0, Q2 > 0, T1 > T2. |
Устройство, работающее по холодильному циклу, может иметь двоякое предназначение. Если полезным эффектом является отбор некоторого количества тепла |Q2| от охлаждаемых тел (например, от продуктов в камере холодильника), то такое устройство является обычным холодильником. Эффективность работы холодильника можно охарактеризовать отношением

|
т. е. эфективность работы холодильника – это количество тепла, отбираемого от охлаждаемых тел на 1 джоуль затраченной работы. При таком определении βx может быть и больше, и меньше единицы. Для обращенного цикла Карно
|
Если полезным эффектом является передача некоторого количества тепла |Q1| нагреваемым телам (например, воздуху в помещении), то такое устройство называется тепловым насосом. Эффективность βТ теплового насоса может быть определена как отношение

|
т. е. количеством теплоты, передаваемым более теплым телам на 1 джоуль затраченной работы. Из первого закона термодинамики следует:
| |Q1| > |A|, |
следовательно, βТ всегда больше единицы. Для обращенного цикла Карно
|
3.12. Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии window.top.document.title = "3.12. Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии";
Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами:
|
Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. На рис. 3.12.1 изображены устройства, запрещенные первым законом термодинамики.

|
| Рисунок 3.12.1. Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1. |
Первый закон термодинамики не устанавливает направления тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
Если рабочее тело тепловой машины приводится в контакт с тепловым резервуаром, температура которого в процессе теплообмена остается неизменной, то единственным обратимым процессом будет изотермический квазистатический процесс, протекающий при бесконечно малой разнице температур рабочего тела и резервуара. При наличии двух тепловых резервуаров с разными температурами обратимым путем можно провести процессы на двух изотермических участках. Поскольку адиабатический процесс также можно проводить в обоих направлениях (адиабатическое сжатие и адиабатическое расширение), то круговой процесс, состоящий из двух изотерм и двух адиабат (цикл Карно) является единственным обратимым круговым процессом, при котором рабочее тело приводится в тепловой контакт только с двумя тепловыми резервуарами. Все остальные круговые процессы, проводимые с двумя тепловыми резервуарами, необратимы.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона:
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». В земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 1021 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈ 1024 Дж), эквивалентное полному сжиганию 1017 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 104 раз меньше. Поэтому «вечный двигатель второго рода» был бы для человечества не менее привлекателен, чем «вечный двигатель первого рода», запрещенный первым законом термодинамики.
Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики:
Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.
На рис. 3.12.2 изображены процессы, запрещаемые вторым законом, но не запрещаемые первым законом термодинамики. Эти процессы соответствуют двум формулировкам второго закона термодинамики.

|
| Рисунок 3.12.2. Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – «вечный двигатель второго рода»; 2 – самопроизвольный переход тепла от холодного тела к более теплому («идеальная холодильная машина»). |
Следует отметить, что обе формулировки второго закона термодинамики эквивалентны. Если допустить, например, что тепло может самопроизвольно (т. е. без затраты внешней работы) переходить при теплообмене от холодного тела к горячему, то можно прийти к выводу о возможности создания «вечного двигателя второго рода». Действительно, пусть реальная тепловая машина получает от нагревателя количество теплоты Q1 и отдает холодильнику количество теплоты Q2. При этом совершается работа A = Q1 – |Q2|. Если бы количество теплоты |Q2| самопроизвольно переходило от холодильника к нагревателю, то конечным результатом работы реальной тепловой машины и «идеальной холодильной машины» было бы превращение в работу количества теплоты Q1 – |Q2|, полученного от нагревателя без какого-либо изменения в холодильнике. Таким образом, комбинация реальной тепловой машины и «идеальной холодильной машины» равноценна «вечному двигателю второго рода». Точно также можно показать, что комбинация «реальной холодильной машины» и «вечного двигателя второго рода» равноценна «идеальной холодильной машине».
Второй закон термодинамики связан непосредственно с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, т. е. он не может быть осуществлен полностью в обратном направлении.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
На основании любой из формулировок второго закона термодинамики могут быть доказаны следующие утверждения, которые называются теоремами Карно:
1. Коэффициент полезного действия тепловой машины, работающей при данных значениях температур нагревателя и холодильника, не может быть больше, чем коэффициент полезного действия машины, работающей по обратимому циклу Карно при тех же значениях температур нагревателя и холодильника.
2. Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Таким образом, коэффициент полезного действия машины, работающей по циклу Карно, максимален.
|
Знак равенства в этом соотношении соответствует обратимым циклам. Для машин, работающих по циклу Карно, это соотношение может быть переписано в виде
Поиск по сайту:










