 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 10. НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ
· Δ Н характеризует:
ü стремление системы к состоянию с минимальной Е
ü объединению атомов или др. частиц в молекулы Þ
укрупнению по определенному порядку
· Δ S характеризует:
ü стремление системы к беспорядочному расположению частиц
ü стремление к дезагрегации,
т.е. противоположную тенденцию
! Направление любого процесса определяется соотношением этих двух тенденций
Для количественного сопоставления их необходимо выразить в одинаковых величинах:
∆ r Н [кДж/моль]• 10-3 -энтальпийный фактор реакции
Δ r S [Дж/(моль•К] • Т [K]
Т ∆ r S - энтропийный фактор реакции
Движущая сила химического процесса (Р,Т = const), учитывающая одновременно изменение энергетического баланса и степени ее беспорядка:
∆ G - изменение изобарно-изотермического потенциала
или энергия Гиббса G = H – TS
G – функция состояния системы (не зависит от пути процесса)
! абсолютного значения G определить нельзя
Изменениение энергии Гиббса химической реакции:
| ∆ r GТ = (∆ r HТ – T ∆ r SТ) |
∆ r G характеризует реакционную способность системы:
убыль энергии Гиббса (Р,Т = const) равна максимальной полезной работе реакции
A пол = -D r G
| A пол = -D r G |
В изобарно-изотермических условиях (Р, Т = const) является однозначным критерием возможности самопроизвольного протекания реакции в прямом направлении
∆ r GT < 0
D r G < 0 – самопроизвольный процесс – реакция в прямом направлении;
D r G > 0 – самопроизвольный процесс – реакция в обратном направлении;
D r G = 0 – реакция в равновесном состоянии
Для обратимого процесса:
А (г) Û В (г)
из уравнения ∆ r GТ = ∆ r HТ – T ∆ r SТ следует, что если:
∆ r H < 0, ∆ r S ˃ 0 – ∆ r G < 0 Þ прямая реакция возможна при любой Т
∆ r H ˃ 0, ∆ r S < 0 – ∆ r G ˃ 0 Þ прямая реакция невозможна, при любой Т - обратная реакция
Знак ∆ r G определяется соотношением энтальпийного и энтропийного факторов и зависит от Т, если:
∆ r H < 0, ∆ r S < 0 – прямая реакция возможна при низких Т
∆ r H ˃ 0, ∆ r S ˃ 0 – прямая реакция возможная при высоких Т
Энергия Гиббса образования вещества ∆ f Gi:
энергия Гиббса реакции образования 1 моля i- вещества из простых веществ, устойчивых в данных условиях
∆ fGi 0- стандартная энергия Гиббса образования i - вещества (все вещества находятся в стандартном состоянии)
∆ fGi 0298, [кДж/моль ] - табулированные величины (см. справоснные данные)
Расчет стандартной энергии Гиббса Δ r G 0
(все вещества находятся в стандартном состоянии)
1. По следствию из закона Гесса (используя справочные данные):
2. По уравнению:
Δ r G = ∆ r H − T ∆ r S
при Т = 298 К при  Т ≠ 298 К
Т ≠ 298 К
Δ r G0298 = ∆ r H0298 – T ∆ r S0298 Δ r G0T = ∆ r H0T − T ∆ r S0T
если принять, что ∆ r С 0 р = 0, т.е. теплоемкость системы не изменяется при прохождении реакции
Δ r G0Т = ∆ r H0298 – T ∆ r S0298
Если вещества, участвующие в реакции, находятся в нестандартном состоянии расчет Δ r G по уравнению изотермы Вант Гоффа:
для реакции
a A (г) + b B(г) + d D(к) = e E(г) + f F(г)
Δ r GТ = ∆ r G0Т + RT ln 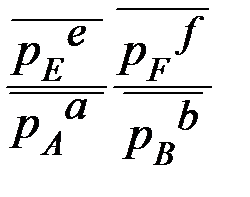
 – исходные относительные парциальные давления
– исходные относительные парциальные давления
газообразных веществ
 = p атм/1 атм = p кПа/100 кПа = p Па/105 Па
= p атм/1 атм = p кПа/100 кПа = p Па/105 Па
! В уравнение изотермы Вант Гоффа входят только относительные парциальные давления газообразных веществ
Если относительные давления всех газов равны 1 (стандартное состояние), то Δ r GТ = ∆r G 0 Т
Δ r G0298 ≠ Δ r G0Т при Т отличной от 298 К
Δ r G0298, Δ r G0Т не являются критериями направления или предела самопроизвольного протекания реакции в условиях отличных от стандартных
Физический смысл Δ rG
Тепловой эффект реакции: ∆ r HT = Δ rGT + T ∆ rST
Δ rGT = - A полезная – «свободная энергия», -
часть теплового эффекта, которую можно превратить в работу;
Т Δ rS – «связанная энергия», - часть теплового эффекта, которая бесполезно рассеивается в окружающую среду.
Т
∆ r S0T = ∆ r S 0298 +∫  dT dT
|
| ∆ r GТ = (∆ r HТ – T ∆ r SТ) |
Определите возможность самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и 1000 К и стандартных состояниях всех компонентов (∆r Н0Т и ∆r S0T - не зависят от Т).
Решение. Возможность самопроизвольного протекания реакции определяется неравенством ∆ rG0T< 0
∆ r G0Т = ∆ r H0Т - T ∆ rS0Т = ∆ r H0298 - T ∆ r S0298
∆ r G0298 = 172,5 – 298 .175,66.10-3 = 120,15 кДж > 0 –
реакция в прямом направлении невозможна (энтальпийный фактор преобладает и не способствует самопроизвольному протеканию прямой реакции).
∆ r G01000 = 172,5 – 1000.175,66.10-3 = -3,16 кДж < 0 - реакция в прямом направлении возможна (энтропийный фактор преобладает при высоких температурах и способствует самопроизвольному протеканию прямой реакции).
| Δ r G0298 =∑ν i Δ f G0298, i продуктов-∑ν j Δ f G 0298, j исх веществ |
При каком соотношении парциальных давлений газообразных компонентов реакции и 298 К
С(к) + СО2(г) = 2СО(г)
| A пол = -D r G |
Т
∆ r S0T = ∆ r S 0298 +∫  dT dT
|
По уравнению изотермы Вант-Гоффа:
Δ rG298 = ∆rG0298 + RT ln  < 0.
< 0.
Т
∆ r S0T = ∆ r S 0298 +∫  dT dT
|
 < 0
< 0
ln  < - 48,5 Þ
< - 48,5 Þ  < 10-21
< 10-21
ЗАДАЧА.
Определить температурную область самопроизвольного протекания реакции:
С (к) + СО2 (г) = 2СО (г)
при стандартных состояниях компонентов.
Решение. Реакция протекает самопроизвольно при стандартных состояниях компонентов, если:
∆ rG0Т = ∆ rH 0298 +  ∆ rС0pdT - Т ∆ rS0 298- Т
∆ rС0pdT - Т ∆ rS0 298- Т  ∆ rС0p/T) dT < 0
∆ rС0p/T) dT < 0
Если ∆ rH0 и ∆ rS0 не зависят от температуры:
∆ rG0Т ≈ ∆ rH0298 - T ∆ rS0298 < 0.
(172,5 – Т .175,66.10-3) < 0 (размерность!)
Т > 982 К
Температурный интервал (из справочных данных):
С (графит) 298 – 2300 К
СО2 (г) 298 – 2500 К
СО (г) 298 – 2500 К Þ
искомая область температур: 982 ÷ 2300 К

Поиск по сайту: