 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 13. ОСНОВЫ КИНЕТИКИ СЛОЖНЫХ И ГЕТЕРОГЕННЫХ РЕАКЦИЙ
Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством (поверхностью). Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. С учетом площади поверхности равной S общая скорость гетерогенной реакции первого порядка описывается уравнением:

|
где с – концентрация реагента (газообразного или жидкого).
Единица измерения скорости гетерогенной реакции в этом случае – [моль×с-1], константы скорости реакции– [м×с-1]. Если в реакции непосредственно участвует твердое вещество, то в кинетическое уравнение не входит его концентрация, так как она постоянна.
Например, кинетика гетерогенной реакции
СаО(к) + СО2 = СаСО3(к)
описывается уравнением:
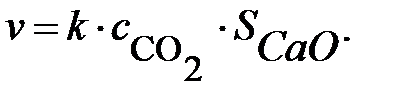
|
Иногда важно знать удельную скорость реакции, отнесенную к единице площади реакционной поверхности, которая для реакции первого порядка описывается уравнением:

|
Единица измерения удельной скорости реакции [моль×с-1×м-2].
Скорость гетерогенной химической реакции зависит от скорости подвода реагента и отвода продукта с поверхности раздела фаз (зона химической реакции), что является второй особенностью этих реакций.

 Скорость обратимых гетерогенных, как и гомогенных, реакций зависит от скоростей прямой и обратной реакций.
Скорость обратимых гетерогенных, как и гомогенных, реакций зависит от скоростей прямой и обратной реакций.
Для реакции А + В = Д + К
 = k пр СА С В – kобр СD СK = k пр СА С В – kобр СD СK
|
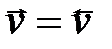 или kпр СА С В = kобр СD СK
или kпр СА С В = kобр СD СK
или СD СK/ СА С В = Kc = kпр/ kобр
Т.е. константа равновесия гетерогенной химической реакции равна отношению констант скоростей прямых и обратных реакций

|
Итак, общая скорость необратимой гетерогенной химической реакции зависит, а удельная скорость реакции не зависит от площади реакционной поверхности. На скорость гетерогенной химической реакции влияют процессы массопереноса. Скорость обратимой реакции определяется разностью скоростей прямой и обратных реакций.
Цепные реакции
Особое место в химической кинетике занимают цепные реакции. Эти реакции имеют ряд особенностей. Скорость их зависит от природы и объема сосуда, от наличия в нем посторонних примесей, для некоторых из них характерен порог давления, ниже которого реакция не идет. При определенных условиях цепная реакция представляет лавинообразный процесс, протекающий чрезвычайно быстро с возможностью взрыва.
Химические превращения с цепным механизмом реакции достаточно распространены в химии газообразных веществ. К цепным реакциям относятся реакции сгорания топлива, окисления молекулярных галогенов кислородом, хлорирования и бромирования, многие процессы полимеризации, крекинг тяжелых нефтепродуктов, процессы получения ядерной энергии и др. Впервые идею о возможности цепного механизма реакций высказал русский ученый Н. А. Шилов в 1905 г. Большой вклад в разработку теории цепных реакций внесли русские ученые и в первую очередь академик Н. Н. Семенов.
Цепными называются химические реакции, в которых появление активной частицы вызывает не одно, а несколько последовательных химическихпревращений с передачей энергии вновь образующимся частицам. Число химических превращений, вызываемых одной активной частицей – длина цепи
Активными частицами могут быть свободные атомы, ионы, радикалы и возбужденные молекулы. (Свободные радикалы представляют собой частицы, обладающие ненасыщенными валентностями и повышенной реакционной активностью)
Механизм цепных реакций.
1 стадия Цепные реакции начинаются со стадии инициирования или зарождения цепи т.е. образования активных частиц (принято обозначать точкой, поставленной рядом с химическими символами, например Сl·, ОН·, Н·, СН3СО·).
Инициирование происходит в результате воздействия на систему светом, излучением высокой энергии, теплом и т. д.
Потребление энергии на инициирование в цепных реакциях невелико, так как активируются не все молекулы, а только небольшая их доля.
2 стадия - рост (продолжение) цепи. Это процесс интенсивного возрастания скорости за счет химических превращений, вызываемых одной активной частицей. Этот процесс происходит до тех пор, пока существует активная частица.
3 стадия - обрыв цепи. Это процесс, в результате которого активные частицы или исчезают, или дезактивируются. Обрыв цепи может произойти в результате столкновения активной частицы со стенкой сосуда и дезактивации в результате адсорбции на стенке или взаимодействия с другой активной частицей при столкновении.
Вследствие образования активных частиц цепные реакции протекают быстрее реакций, идущих по обычному механизму.
Известны две разновидности цепных реакций: с неразветвленными и с разветвленными цепями.
Первые возникают в том случае, если одна активная частица при своем взаимодействии вызывает образование только одной новой активной частицы.
Разветвленные цепные реакции характеризуются разветвлением цепи, т.е. одна активная частица вызывает образование двух и более активных частиц.
Скорость цепной реакции зависит от:
1. внешних параметров (Р, Т, скорость отвода тепла….)
2. конструкции машины (аппарата, реактора…)
3. присутствия посторонних веществ в зоне реакции
V = V лимитирующей стадии
В качестве примера рассмотрим реакцию горения водорода в кислороде.
При низкой Т активные частицы не зарождаются (цепная реакция не идет)
Однако при Т близкой к 500 0 С (и невысоких Р) протекает цепная реакция с выделением тепла, заканчивающаяся взрывом (в закрытом сосуде). Взрыв гремучего газа:
| Н2 + О2 ® 2НО· зарождение цепи НО· + Н2 ® Н· + Н2О рост цепи Н· + О2 ® НО· + О· разветвление цепи О· + Н2 ® Н· + НО· и т.д |
Затем возникшие частицы вызывают появление новых; скорость реакции резко возрастает и в конце концов происходит взрыв. Это разветвленная химическая реакция.
По мере изучения цепных реакций выяснилось, что они не представляют собой исключение из правил, а встречаются довольно часто в природе и технике.
В энергетике по цепному механизму идут, например, реакции горения многих газовых смесей в печах, при сварке, резке, пайке металлов, при работе паровых котлов, реакторов, при окислении гидромасел в гидроприводах и т.д. В двигателях внутреннего сгорания цепной характер реакции может вызывать микровзрывы (детонацию), для их предупреждения в топливо вводят антидетонаторы (присадки), на которых происходит обрыв цепей.
ЛЕКЦИЯ 14. ДИСПЕРСНЫЕ СИСТЕМЫ И ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
Поиск по сайту: