 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 5. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Гибридизация атомных орбиталей
Гибридизация – выравнивание АО (близких по Е) атома по форме и энергии

s-p –гибридная орбиталь «неравномерная восьмерка»
sp –гибридизация
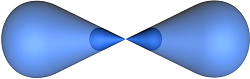 s - АО р - АО s-p -гибридные sp - гибридизация АО
s - АО р - АО s-p -гибридные sp - гибридизация АО
орбитали Ð1800
· Гибридные АО в пространстве максимально удалены друг от друга пронстранстве
· Перекрывание гибридных АО по s-связи сильнее, чем негибридных Þ Е гибр. связей ↑ Þ устойчивость частицы максимальна
 sp 2 –гибридизация
sp 2 –гибридизация

s - АО р - АО s-p -гибридные sp 2- гибридизация АО
орбитали Ð1200
АО расположены в одной плоскости
sp 3 –гибридизация
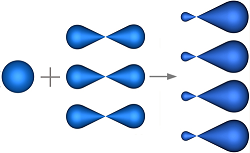

s - АО р - АО s-p -гибридные sp 3- гибридизация АО
орбитали Ð109,40
АО расположены в пространстве
от центра тетраэдра к его вершинам
Структура многоатомных молекул
1. Трехатомные молекулы (АВ2)
А: центральный атом (ЦА) s -, d - металл с В*= 2 (валентные е -: s, p)
В: одновалентный атом
BeH2, CaI2, CdCl2, ZnBr2 и т.п (многие гидриды и галогениды Me)
Молекула BeH2
Если валентные е - центрального атома находятся на различных подуровнях (s, p) – имеет место гибридизация АО

Н Ве в Н
sp -гибридизации
s –связи, механизм образования: обменный
ЭО(Ве) = 1,5; ЭО(Н) = 2,1; ∆ЭО ¹0 Þ m св ¹ 0 Þ связи полярные
Полярность многоатомных молекул
 - электрический момент диполя молекулы
- электрический момент диполя молекулы
равен векторной сумме электрических моментов диполей всех связей:
 =
= 
Если  = 0 Þ молекула неполярная
= 0 Þ молекула неполярная
Если  ¹ 0 Þ молекула полярная
¹ 0 Þ молекула полярная
! Полярность молекулы зависит от ее геометрической структуры
! если гибридные АО центрального атома взаимодействуют с
АО других одинаковых атомов ( одинаковы) Þ
одинаковы) Þ
молекулы неполярные (СН4, ВF3).
! если гибридные АО взаимодействуют с АО разных атомов
( различны) Þ молекулы полярные (CH2Br2, ВF2Cl)
различны) Þ молекулы полярные (CH2Br2, ВF2Cl)
Н Be ® Н
 =
=  = 0 молекула неполярная
= 0 молекула неполярная
2. Четырехатомные молекулы (АВ3)
А: ЦА - элемент IIIА подгруппы с В*= 3
В: одновалентный атом
ВH3, AlCl3, GaI3 и т.п. молекулы
Молекула ВCl3
σ-связи, механизм образования: обменный
ЭО(В) = 2,0; ЭО(Cl) = 3,0, ∆ЭО ¹0
Þ mсв ¹ 0 Þ связи полярные
структура молекулы – треугольная
· Ð1200
 =
=  = 0 Þ молекула неполярная
= 0 Þ молекула неполярная
!Валентные е- бора находятся на разных подуровнях (s, p, p)
sp 2 –гибридизация АО атома В
3. Пятиатомные молекулы (АВ4)
А: ЦА - элемент IVА подгруппы с В*= 4
В: одновалентный атом
СH4, GeCl4, PbI4 и т.п. молекулы
CH4 (метан)
!Валентные е- ЦА находятся на разных подуровнях (s, p, p, p)
 sp 3 – гибридизация АО
sp 3 – гибридизация АО
σ- связи, механизм образования: обменный
ЭО(C) =2,5; ЭО(Н) = 2,1 ∆ЭО ¹0 Þ m св ¹ 0 Þ
связи полярные
структура – тетраэдрическая
Ð109,30
 =
=  = 0 → молекула неполярная
= 0 → молекула неполярная
. Четырехатомные молекулы (ВА3)
А: ЦА - элемент VА подгруппы с В0= 3
В: одновалентный атом
PCl3, AsH3, SbI3 и т. п. молекулы
Молекула SbH3
!Валентные е- ЦА находятся на одномподуровне (p) гибридизации АО нет
σ- связи, механизм образования: обменный
· ЭО(Sb) =1,9; ЭО(Н) = 2,1 ∆ЭО ¹0 Þ m св ¹ 0 Þ связи полярные
· структура молекулы – пирамидальная
·  =
=  ≠ 0 Þ молекула полярная
≠ 0 Þ молекула полярная
Трехатомные молекулы (В2А, АВ2 )
А: ЦА - элемент VIА, IVA подгруппы с В0= 2
В: одновалентный атом
! Валентные е- ЦА (S) на одномподуровне (p)
гибридизации АО нет
2 σ- связи, механизм образования: обменный
ЭО(S) = 2,5; ЭО(Н) = 2,1 ∆ЭО ¹0 Þ m св ¹ 0 Þ
 связи полярные
связи полярные
структура – угловая
 =
=  ≠ 0 Þ молекула полярная
≠ 0 Þ молекула полярная
Молекулы NН3 и Н2О
| Молекула | Валентный угол, 0 | ↑ R ат р - элемента, ↑ l св ↓ эффект отталкивания и орбиталями связей валентный угол↓ | Молекула | Валентный угол, 0 |
| H2O | 104,5 | NH3 | 107,3 | |
| H2S | 92,1 | PH3 | 93,6 | |
| H2Se | 90,9 | AsH3 | 92,1 | |
| H2Te | 90,2 | SbH3 | 91,7 |
! Метод ВС не объясняет сильно отличающуюся от 900 величину углов в молекулах NН3 и Н2О, определенную методом рентгеноструктурного анализа.
Предполагают:
sp 3 – гибридизацию АО азота «N» и кислорода «О».
N…2 s 22 p 3 O…2 s 22 p 4
sp 3 sp 3
H 1 s 1 H 1 s 1 H1 s 1 Н 1 s 1 Н 1 s 1
ИОННАЯ СВЯЗЬ
● связь, образованная в результате электростатического
взаимодействия ионов
● предельный случай полярной ковалентной связи
● образуется при взаимодействии элементов значительно
различающихся по электротрицательности (∆ЭО ≥ 1,7)
(элементы IA, IIA + VIA, VII подгрупп)
cильное смещение е - - плотности приводит к образованию ионов:
Na - ē → Na + (катион) Cl + ē →Cl- (анион)
ЭО (Na) = 0,9 ЭО (Cl) = 3,0
● чисто ионной связи не существует
● долю ионного характера связи называют степенью ионности
● степень ионности связи ↑ c ↑∆ЭО, образующих ее атомов
Ионная связь не обладает
● насыщаемостью
●направленностью
●повышенной е - -плотностью в области связывания
! Понятие валентности к ионной связи неприменимо
Ионные кристаллы - гигантские полимерные молекулы
Формулы (NаСl, СаF2) - отражают лишь состав
● Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион
● Сила взаимодействия ионов определяются величиной их заряда и расстоянием между ними по закону Кулона
● Ионные связи - прочные
● Кристаллические вещества ионного типа
- тугоплавкие (↑ Т пл),
- высокопрочные, но хрупкие
- растворяются в полярных растворителях (в Н2О)
ионную структуру имеют в основном соединения щелочных и щелочноземельных металлов (солей, оксидов).
KF, KBr, KI, RbCl, MgO, CaO, BaO, NaNO3, KNO3, KCl, LiCl, LiNO3 и др.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
● реализуется в Ме, которые имеют кристаллическое строение
● При образовании кристалла Ме:
- АО сближающихся атомов перекрываются
- валентные ē всех атомов свободно перемещаются по
валентным АО, испытывая притяжение всех ядер
●Совокупность делокализованных, обобществленных, подвижных ē образует электронный газ
Металлическая связь
– притяжение между ионами в узлах Ме - кристалла и обобществленными делокализованными ē
- не обладает свойствами насыщаемости и направленности
- Е Ме-связи < Е ков. связи
Металл – плотноупакованная кристаллическая структура, в которой ионы атомов Ме, находящиеся в узлах металлической решетки связаны друг с другом электронным газом
Природа металлической связи обеспечивает свойства, характерные для всех металлов:
● характерный блеск
● высокая отражательная способность поверхности
● высокая тепло- и электропроводность
(вследствие наличия свободных электронов)
● ковкость и пластичность
(вследствие относительной подвижности ионов металлов в узлах решетки)
Поиск по сайту: