 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Ступенчатая диссоциация
Многоосновные слабые кислоты и многокислотные основания диссоциируют ступенчато:
1 ст: H2SО3  Н+ + HSО3- К Д1 = 1,7×10-2
Н+ + HSО3- К Д1 = 1,7×10-2
2 ст: HSО3-  H+ + SО32- К Д2 = 6,3×10-8 К Д1 ˃˃ К Д2
H+ + SО32- К Д2 = 6,3×10-8 К Д1 ˃˃ К Д2
! В растворах преобладают ионы, образующиеся на I ступени диссоциации (все расчеты только по I ст диссоциации)
При разбавлении раствора, ↑ Т и пр. можно достигнуть диссоциации и по другим ступеням
ПРИМЕР
Оцените степень диссоциации a по 1-й ступени в 0,005 М и 0,05 М растворах сернистой кислоты Н2SО3.
Решение.
Н2SО3  Н+ + НSО3-, К Д1 = 1,7×10 -2 (1-я ступень)
Н+ + НSО3-, К Д1 = 1,7×10 -2 (1-я ступень)
! значение К Д1 относительно велико (> 10-4) Þ
расчет a по строгой формуле Оствальда:
К Д = a2 с 0/(1 - a).
· 
Для 0,005 М раствора:
! Расчет по приближенной формуле (К Д» a2 с 0) приводит к величине a > 1, что не имеет смысла.
· Для 0,05 М раствора


Значение a, рассчитанное по приближенной формуле (» 0,58) сильно отличается и неверно!
a - уменьшается с ↑ концентрации
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
Диссоциируют» полностью:
CaCl2 ® Ca2+ + 2Cl-
Al2(SO4)3 ® 2Al3+ + 3SО42-
· с ионов ↑
· между ионами – электростатическое взаимодействие
Þ каждый ион окружен противоположно заряженными ионами – ионная атмосфера
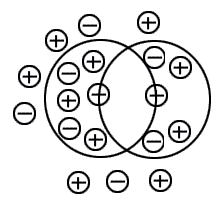
 Модель ионной атмосферы
Модель ионной атмосферы
Þ
↓ подвижности ионов, кажущееся ↓ с ионов по сравнению с аналитической
Характеристика состояния иона сильного электролита –
активность (а), [моль/л]-
с ионов, в соответствии с которой они действуют в химической реакции
(мера реального поведения ионов)
с разбавлением раствора а → с
а = g× с
γ - коэффициент активности -
- степень отклонения поведения раствора сильного электролита от идеального раствора (безразмерная величина)
γ – учитывает все виды взаимодействий между ионами
γ < 1, а < с - растворы сильных электролитов (с < 0,1 моль/л)
γ = 1, а = с - растворы слабых электролитов и разбавленные растворы сильных электролитов (с < 10 -4 моль/л)
γ – определяется ионной раствора (I)
I = 0,5×å(сi ×× z2i)
ci – концентрация i -иона
zi - заряд i -иона
I – характеризует интенсивность электрического поля ионов в растворе
Коэффициенты активности отдельных ионов g i определяют:
1) по формулам:
если I £ 0,01 
если 0,1 ≥ I > 0,01 
если 1 > I > 0,1 
g зависят от концентрации и заряда ионов
и мало зависят от природы растворенных веществ.
2) по правилу ионной силы (приближенно):
ионы с одинаковой абсолютной величиной заряда в разбавленных растворах сильных электролитов с одинаковой ионной силой имеют равные коэффициенты активности
γ для некоторой величины I рассчитывают по таблице методом интерполяции, допуская линейную зависимость γ от I в данном интервале
С ↑ ионной силы активность ионов ↓
ПРИМЕР.
Рассчитайте активность ионов в 0,01 М растворе СаСl2.
СаCl2 ® Ca2+ + 2Cl-
С, моль/л: 0,01 0,012×0,01


 = 0,87×0,02 = 1,74×10-2 (моль/л)
= 0,87×0,02 = 1,74×10-2 (моль/л)

ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Самоионизация воды:
Н2О + Н2О  Н3О+ + ОН-
Н3О+ + ОН-
упрощенно:
Н2О  Н+ + ОН-
Н+ + ОН-
D H 0 298 дисс = 55,9 кДж
D S 0298 дисс = - 80,48 Дж/К
а Н2О = const ≈ 55,5моль/л

ионное произведение Н2О:
 (*)
(*)
K 298 W = 1,86×10 -16 × 55,5 = 10 -14
K 398 W = 6,2 ×10 -13
! D H 0дисс Н2О > 0 Þ К W растет с ↑ T.
D G 0дисс = D Н 0дисс –ТD S 0дисс = - RTlnKW
lnKW = – 55900/8,31×298 – 80,48/8,31×298 Þ K 298 W = 10 -14
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ
При Т = 298 К:
ионы Н+ - носители кислотных свойств
ионы ОН - - носители основных свойств.
Прологарифмируем (*)
lgK W = lga H+ + lga OH- = -14
обозначают:
- lga H+ = рН - водородный показатель среды
- lga OH- = рОН - гидроксильный показатель среды
| Среда | СН+, моль/л | СОН-, моль/л | рН |
| нейтральная | 10-7 | 10-7 | |
| кислая | >10-7 | <10-7 | <7 |
| щелочная | <10-7 | >10-7 | >7 |
логарифмическая форма ионного произведения Н2О:

Поиск по сайту: