 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 4. ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь – совокупность сил, действующих между частицами и обусловливающих образование устойчивых структуры: молекул, ионов, кристаллов и других систем.
! при образовании химической связи всегда выделяется Е
Основные типы химической связи
1. ионная
2. ковалентная
3. металлическая
Основные параметры химической связи
Энергия связи Е св, кДж/моль - количество энергии, выделяющееся при образовании химической связи в расчете на 1 моль вещества.
Длина связи l св, нм -расстояние между ядрами химически связанных атомов.Зависит от размеров е-- оболочек и степени их перекрывания
КОВАЛЕНТНАЯ СВЯЗЬ
Химическая связь, образованная путем обобществления пары е- двумя атомами называется ковалентной.
Сопровождается образованием:
- общей пары е-,
- повышенной е- - плотности между атомами;
Образуется:
- только при взаимодействии е- с антипараллельными спинами (принцип Паули);
 Зависимость энергии систем из 2-х атомов водорода с антипараллельным (1) и параллельными (2) спинами от расстояния между ядрами.
Зависимость энергии систем из 2-х атомов водорода с антипараллельным (1) и параллельными (2) спинами от расстояния между ядрами.
Е – энергия связи, l – длина связи
При сближении двух атомов Н с параллельными спинами е- (↑↑) с ↓расстояния между ними, Е системы возрастает → связь не образуется
Если спины е- противоположно направлены (↑↓), на определенном расстоянии Е системы из двух атомов минимальна (Е min) → образуется молекула

| + |

| + |
| + |

Н Н Н2
Е св = Е образования молекулы  n связей
n связей
N + 3H = NH3
Е образования молекулы =1170 кДж/моль, Е св N-H =1170/3 = 390 кДж/моль
| связь | Е св, кДж /моль | l св, нм | Вывод |
| F – F | 159,0 | 0,142 | Rат ↓, lсв↓ Есв ↑ |
| H – H | 436,0 | 0,074 |
| связь | Е св, кДж /моль | l св, нм | Вывод |
| H – Cl | 427,0 | 0,128 | Rат (галогена) ↑, lсв↑ Есв ↓ |
| H - Br | 361,0 | 0,162 | |
| H – I | 294,0 | 0,412 |
ВЫВОДЫ:
! Чем ↑ Е св, тем она прочнее
! Чем ↓ l св, тем ↑ Е св и устойчивее молекула
Механизмы образования ковалентной связи
1. обменный
2. донорно-акцепторный
Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному е -
Донорно-акцепторный механизм - из двух связываемых атомов один (донор) выделяет неподеленную пару е-, а другой (акцептор) – свободную орбиталь
ОбменныйДонорно-акцепторный 
А –акцептор, D – донор
Ион аммония:
 Механизмы образования связей:
Механизмы образования связей:
три связи - по обменному механизму,
одна связь - по донорно-акцепторному: ‘N’-донор,‘H+’-акцептор
Схема образования молекулы оксида углерода (II) СО
| C O |
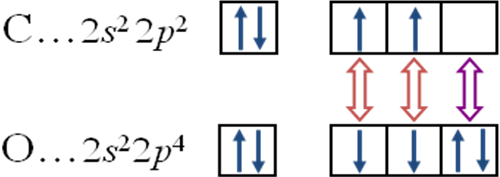
Механизмы образования связей:
две связи по обменному механизму,
одна связь по донорно-акцепторному: ‘O’-донор,‘C’-акцептор.
! Валентности ‘C’ и ‘O’ в молекуле СО равны 3
В атома = Вобм + В д-а
Частный случай д-а взаимодействия: дативные связи – образуются, когда АО одного атома, могут выступать одновременно в роли и донора и акцептора неподеленных пар е-.

Схема образования молекулы Cl2
! Е св(Сl2) = 243 кДж/моль и ↑, чем Е св(F2) = 159 кДж/моль,
несмотря на то, что lсв (Сl2) > lсв (F2)
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
1.Насыщаемость
В образовании связи могут участвовать только валентные е -
! Атом образует не любое, а ограниченное число связей
2.Направленность
· АО пространственно ориентированы
· Перекрывание орбиталей происходит в определенных направлениях Þ молекулы имеют определенную пространственную структуру
Типы ковалентной связи
σ – связь π – связь δ - связь
s - связь образуется при перекрывании АО по линии, соединяющей ядра взаимодействующих атомов
Молекула Cl2 Cl …3 s 23 p 5
Cl …3 s 23 p 5

р-р – перекрывание, σ- связь, механизм образования - обменный
структура молекулы - линейная

Молекула Н2
H …1 s 1
H …1 s 1 s-s – перекрывание σ- связь
механизм образования - обменный
структура молекулы -линейная
! Любая одинарная связь в молекуле - s - связь
угол между s - связями – валентный угол (Ð)
π – связь – образуется при боковом перекрывании двух р – облаков, расположенных перпендикулярно линии, соединяющей ядра взаимодействующих атомов

Если у взаимодействующих атомов имеются дополнительные неспаренные е, наряду с s - связью м.б. образованы дополнительные π – связи.
(=), (≡) - кратные связи
Кратность связи - число хим. св. между двумя взаимодействующими частицами
О2N2
О = О N ≡ N
Кратность связи = 2 Кратность связи = 3

3 связи: σ- и две π – связи, механизм образования - обменный
структура молекулы -линейная
δ – связь - образуется при перекрывании двух d- облаков, расположенных в параллельных плоскостях 4-мя лепестками

| молекула | связь | Е св, кДж /моль | l св, нм | Вывод |
| О2 | О = О | 498,7 | 0,120 | Кратностьсвязи ↑ Е св ↑ |
| N2 | N º N | 945,6 | 0,109 |
3. Полярность
неполярная связь образована атомами с одинаковой ЭО (DЭО = 0): Н2, О2 и т.д.
полярная связь образована атомами с различной ЭО
Молекула НCl
H …1 s 1

Cl …3 s 23 p 5
Механизм образования связи — обменный
Ð = 180°, структура - линейная
ЭО(Cl) = 3,0, ЭО(Н) = 2,1
Þ H+ q Cl- q
(- q) – эффективный заряд атома Cl
(+ q) – эффективный заряд атома Н
Количественная мера полярности связи - электрический момент диполя связи
 = q × l д. (Кл×м)
= q × l д. (Кл×м)
q – эффективный заряд атома
l Д – длина диполя - расстояние между центрами тяжести
эффективных зарядов (+ q и – q)
| Молекула | DЭО | 
| Вывод |
| Н2 | Чем ↑ DЭО, тем ↑ m св, ð связь более полярная | ||
| НСl | 0,90 | 1,03 | |
| НBr | 0,74 | 0,78 | |
| HI | 0,40 | 0,38 |
Поиск по сайту: