 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 18. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Элемент Даниэля - Якоби
ЭДС гальванического элемента
Zn│Zn2+││ Cu2+│Cu

В отсутствии тока (разомкнутая цепь) Þ
на границе Ме-раствор равновесие:
Zn  Zn2+ + 2e-
Zn2+ + 2e- 
Cu  Cu2+ + 2e-
Cu2+ + 2e- 
ЕЭ –электродвижущая сила ГЭ (ЭДС) – разность равновесных электродных потенциалов катода и анода
- стандартная ЭДС ГЭ
(активности потенциалобразующих ионов =1 моль/л)
При замыкании цепи Þ равновесие нарушается: во внешней цепи возникает самопроизвольное направленное движение e- от А к К.
Е 0Cu2+/Cu = 0,337 B; Е 0Zn2+/Zn = -0,763 B
ЕЭ = (ЕК – ЕА) > 0 Þ ЕК > ЕА Þ
А (-) – анод: Zn0 ® Zn2+ + 2 e-
окисление (растворение)
К (+) – катод: Cu2+ + 2 e- ® Cu0
восстановление (осаждение)
Суммарная реакция, протекающая в ГЭ – токообразующая реакция:
Zn0 + Cu2+ + 2 e-  Cu0 + Zn2++2 e- (ТОР)
Cu0 + Zn2++2 e- (ТОР)
Е 0Э = Е 0Cu2+/Cu – Е 0Zn2+/Zn = 0,337 – (-0,763) = 1,1 B


 В обратимом процессе (р,Т = cоnst):
В обратимом процессе (р,Т = cоnst):
nF – количество электричества, прошедшее через цепь;
ЕЭ – ЭДС;
n – число моль e-.
 Þ
Þ
EЭ = -D GТОР /(nF)
Для ТОР, протекающей в растворе
а А(р) + b В(т) Û d D(р) + l L(г)
изотерма Вант - Гоффа:
D G ТОР = D G0 ТОР + RTln  (: - nF), имеем
(: - nF), имеем
Е Э = - 
Связь ЭДС с константой равновесия ТОР
D G0 ТОР = - RTlnKa ≈ - RTlnKс Þ

R – универсальная газовая постоянная, 8,31Дж/моль.К;
n – число e-, принимающих участие в реакции
F – число Фарадея, ≈ 96500 Кл/моль;
T – температура, К.
При расчетах обычно принимают ai ≈ ci
При стандартных состояниях реагентов:
а А = а D = 1 моль/л, р L = 1 атм (≈ 105 Па)
E0Э = -D G0ТОР /(nF)
Уравнение Нернста для расчета ЭДС ГЭ при нестандартных состояниях компонентов:
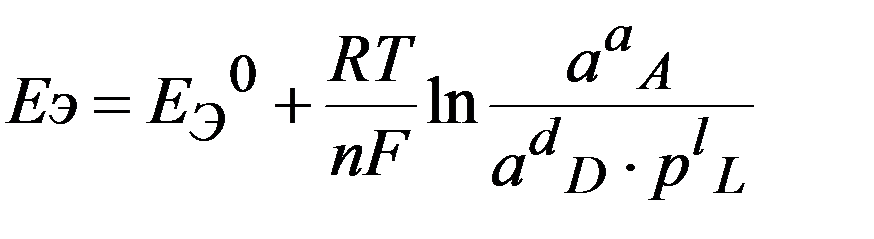 уравнение Нернста
уравнение Нернста
В общем случае:
Ox + n e  Red
Red
окисленная восстановленная
формы вещества
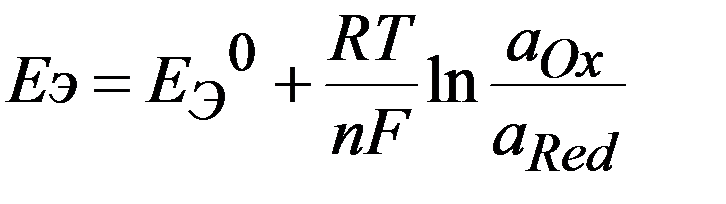 -
-
Если потенциал одного из электродов принять = 0, то относительный потенциал другого электрода буден = Е э Þ
- уравнение Нернста
для расчета равновесного потенциала электрода

0,059 В = 
Абсолютного значения электродного потенциала определить нельзя
За 0 потенциала (при любой Т) принят потенциал стандартного водородного электрода 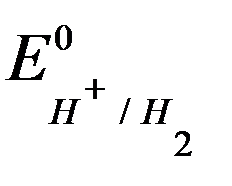
Для измерения Еравн любого электрода составляют электрохимическую цепь из данного и стандартного водородного электродов, причем последний всегда считают анодом.
Ер = 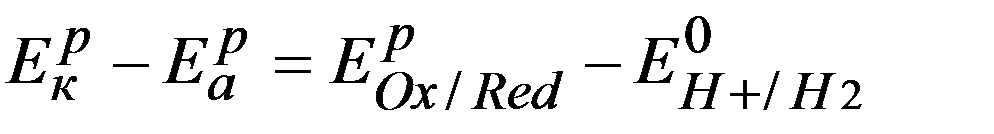
ПОТЕНЦИАЛЫ ГАЗОВЫХ И МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ
СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД

Pt/Pt – платинированная Pt
электролит: Н2SO4
Если:
р (Н2) = 1 атм = 105 Па,
рН = 0, а Н+ = 1 моль/л
Е0 Н+ /Н2 = 0
1. Адсорбция Н2 на Pt/Pt
2. Pt (Au, Pd) не принимает участия в электродной реакции (↑ Е ион)
3. Потенциалопределяющая реакция на границе Pt/Pt, адс. Н2 - раствор:
2Н+(р – р) + 2 е -  Н2 (газ)
Н2 (газ)
окисл. форма восстановл. форма
Уравнения Нернста для расчета нестандартных значений 



Чем ↑ Р Н2, и ↑рН, тем более отрицательные значения принимает 
КИСЛОРОДНЫЙ ЭЛЕКТРОД
Реализуется аналогично водородному электроду.
Pt/Pt – платинированная Pt, электролит: КOН
Если:
р (О2) = 1 атм = 105 Па, рН = 14, а ОН- = 1 моль/л Þ
Е0 О2/ОН- = 0,401 В (отн. стандартного водородного электрода)
Потенциалопределяющая реакция на границе Pt/Pt, адс. О2 - раствор:
О2 (газ) + 2 Н2О + 4 е -  4ОН-(р – р)
4ОН-(р – р)
окисл. форма восстановл. форма

Уравнения Нернста для расчета нестандартных значений
 a H2O = const, a OH- = 10-14/ a H+ Þ
a H2O = const, a OH- = 10-14/ a H+ Þ


Зависимость Ер водородного и кислородного электродов от рН отражает диаграмма Пурбе

МЕТАЛЛИЧЕСКИЕ ЭЛЕКТРОДЫ
Уравнение Нернста для металлических электродов.
Потенциалопределяющая реакция:
M(р-р) n + + n e  M(т)
M(т)
аM = const = 1
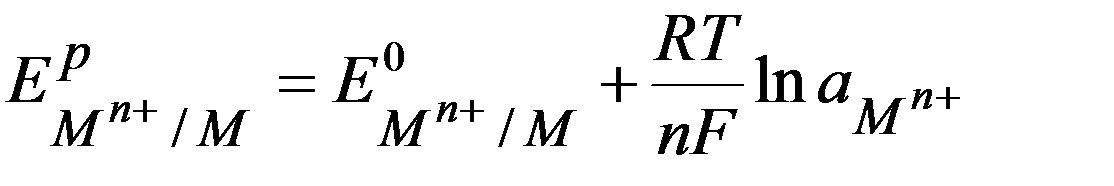
При Т = 298 К и переходе к десятичному логарифму:

Для измерения ЕрМn+/М по водородной шкале собирают ГЭ:
Н2, Pt │H+││M n +│M
измеряют его ЭДС:
ü компенсационным методом с помощью переменной внешней ЭДС
ü высокоомным вольтметром

К А
Еа = Е0 Н+/Н2 = 0 Þ Еэ = Ек - Еа = ЕМn+/М
Задача.
Напишите катодные и анодные процессы, протекающие при работе цинк - серебряного ГЭ, рассчитайте Е 0Э при Т = 298 К двумя способами и Е Э, если а Zn2+ = а Ag+ = 0,01 моль/л.
Решение.Из таблицы стандартных потенциалов:
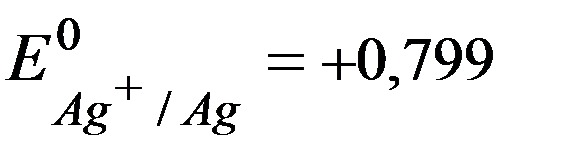 В,
В,  В.
В.
Т.к.  Þ
Þ
Zn – анод (окисление - е -).
Ag – катод (восстановление, + е -),
А: Zn ® Zn+2 + 2e
K: Ag+ + e ® Ag 2 (баланс по е -)
ТОР: Zn + 2Ag+  Zn+2 + 2Ag
Zn+2 + 2Ag
Расчет стандартной ЭДС ГЭ
1)  =
=
= 0,799 – (– 0,763) = 1,562 В
2) 
 = 1,561B.
= 1,561B.
Расчет равновесных нестандартных потенциалов металлических электродов
 B
B
 В
В
Расчет нестандартной ЭДС ГЭ
 = +1,503 В ЕЭ0 > ЕЭ
= +1,503 В ЕЭ0 > ЕЭ
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
Электродные реакции - гетерогенные
i = I / S -плотность тока [A/M2], [MA/cM2]
Величина плотности тока – количественная характеристика скорости электрохимической реакции
Графики зависимости Е =f(i) – поляризационные кривые
Поляризация D Е: отклонение потенциала электрода подтоком Еi от его равновесного значения Еp
D Е = Еi – Еp
D ЕA = ЕAi – ЕAp анодная поляризация
D ЕK = ЕKi – ЕKp катодная поляризация
Поляризационные кривые ГЭ
За счет поляризации (независимо от знака электрода):
Е а Þ более положительным,
Е к Þ более отрицательным
Чем ↑ v электрохимической реакции (величина тока), тем больше потери напряжения (U)
ЕЭ – ЭДС ГЭ;
I(r 1 + r 2 ) - омическое падение напряжения;
r 1 - сопротивлениев проводниках I рода (e- - проводимость) - мало;
r 2 - сопротивление в электролите (проводник II рода, ионная проводимость).
С ростом I и D Е напряжение U - уменьшается
Основные стадии электрохимической реакции:
1. Подвод реагентов к электроду (массоперенос)
2. Собственно электрохимический разряд (перенос е - от частицы на электрод и наоборот)
3. Отвод продуктов реакции от электрода (массоперенос)
Самая медленная стадия лимитирует v всего процесса
Ox + n e  Red
Red
А
ЗДМ для катодного и анодного процессов:
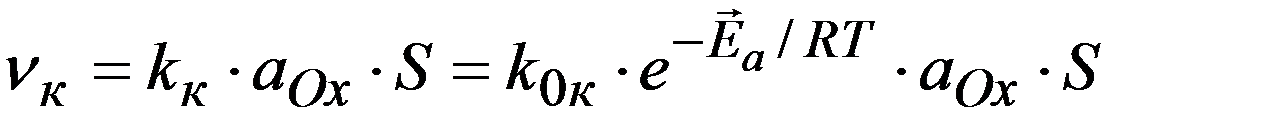
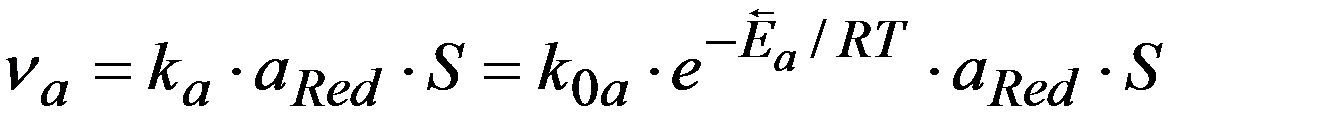
Причины замедленности реакции:
↓ а частиц или ↑ Е а процессов.
Если электродная реакция замедленна из-за:
↑ Е а, поляризация называется электрохимической (∆ Е эх) или перенапряжением
↓ а (конц-и) исходных веществ, либо ↑ а (концентрации)
Электрохимическая поляризация (перенапряжение)
Связь между ∆ Е эх и i (плотностью тока) -
уравнение Тафеля:
D Е эх = а + вlgi
в – const, при Т = 298 К: 0,03 – 0,15 В (чаще 0,1 -0,12 В)
зависит:
ü от природы реакции
ü Т
А – const, при Т = 298 К: 0,0 – 2,0 В
зависит:
ü от природы реакции
ü материала электрода
ü Т
ü состава электролита
Физический смысл а: это величина ∆ Е эх при i =1 А/м2
Зависимость электрохимической поляризации электродов от lg i


Концентрационная поляризация
Обусловлена замедленностью подводов реагентов к поверхности электрода и отводом продуктов реакции в электролит
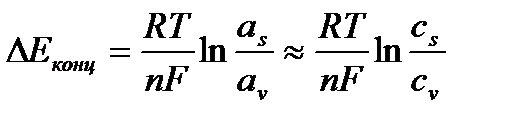
а s,v – активность ионов в приэлектродном слое(s) или в объеме раствора (v) Так, в Zn – Cu г.э. Е а смещается в +сторону, Е к – в – сторону, из-за Сv не равного Сs

D – коэффициент диффузии реагента
d - толщина диффузионного слоя (тонкий слой около поверхности,где частицы переносятся путем диффузии)
D Е конц уменьшается, если:
1) D; 2) Сv; 3) d; 4) перемешивать электролит
Поиск по сайту: