 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЯДРО ЭЛЕКТРОННАЯ ОБОЛОЧКА
ЛЕКЦИЯ 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ
Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
Закон сохранения массы (Ломоносов, Лавуазье, к. XVIII в.): масса веществ, вступающих в реакцию, равна массе веществ, получающихся в результате реакции.
Закон эквивалентов (Рихтер и др., н. XIX в.): разные вещества, обладающие разной массой могут быть равносильны (т.е. эквивалентны) по химическому действию
Г KOH
36 г HCl <
Г NaOH
Все вещества реагируют в эквивалентных отношениях.
Закон постоянства состава (Пруст, н. XIX в.): чистое вещество имеет всегда один и тот же количественный состав независимо от способа его получения
H2O
2: 16
1 г + 8 г → 9 г H2O
Закон кратных отношений (Дальтон, н. XIX в.): если два простых вещества, соединяясь, образуют несколько соединений, то массы одного из них, отнесенные к одной и той же массе другого, относятся между собой как небольшие целые числа
H2O H2O2
2: 16 2: 32
1: 8 1: 16 O: O = 1: 2
Атомистическая теория (Ломоносов, Дальтон, н. XIX в.): все вещества состоят из атомов.
принята в 1860 г. – Международный съезд химиков.
С 1897 г. – открытие физиками:
· электрона (Томсон)
· ядра атома (Резерфорд)
· нейтрона (Чедвик)
· теории строения атома водорода (Нильс Бор) и др.
· волнового характера электрона (Луи де Бройль)
· заряда ядер (Мозли)
ЛЕКЦИЯ 2. СТРОЕНИЕ АТОМА
Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента
АТОМ
ЯДРО ЭЛЕКТРОННАЯ ОБОЛОЧКА
электроны (е-)
протоны (р, р +) - е- - элементарная отрицательная частица,
нейтроны (n, no) носитель наименьшей массы и
другие микрочастицы (> 34) наименьшего электрического заряда
- в ядре сосредоточен весь + заряд и 99,98 % массы атома
- заряд ядра равен числу протонов в нем
| Частица | Кто и когда открыл | Система СИ Заряд, Кл | Атомные ед. заряда | Система СИ масса, кг | Атомные ед. массы |
| е- | Дж. Томсон, 1897 | 1,6.10 -19 | - 1 | 9,11.10-31 | 0,000548 |
| р+ | Э. Резерфорд 1911-1919 | 1,6.10 -19 | + 1 | 1,6.10-27 | 1,007 |
| n0 | Дж. Чедвик, | 1,6.10-27 | 1,008 |
Число р в ядре = числу е- в электронной оболочке атома Þ Атом в целом нейтрален, не имеет заряда.
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом.
Сумма числа протонов (Z) и нейтронов (N) называется массовым (нуклонным) числом (А),
Z + N = A
Разновидности атомов одного химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа называют изотопами. Относительные атомные массы элементов не являются целыми числами, т.к. элементы представляют собой смеси изотопов.
Пример: массовое число 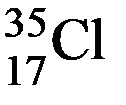 (хлор-35, (17 p +, 18 n, 17 e -))
(хлор-35, (17 p +, 18 n, 17 e -))
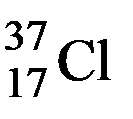 (хлор-37, (17 p +, 20 n, 17 e -))
(хлор-37, (17 p +, 20 n, 17 e -))
Аr (Cl) = 35 · 0,7543 + 37 · 0,2457 = 35,491 а.е.м.
В результате химических реакций ядро атома не претерпевает изменений, изменяются лишь е- - оболочки атомов.
Состояние е- в атоме описывается законами
квантовой механики.
! Квантование энергии (Е): Макс Планк (1900 г., Германия) –
Е распространяется и передается, испускается и поглощается не непрерывно, а дискретно, отдельными порциями - квантами.
Е кванта ~ частоте излучения ν:
E = h·ν,
h – постоянная Планка (6, 626 · 10 –34 Дж · с)
ν = с/λ, с – скорость света (3 · 108 м/с), λ – длина волны.
Þ
Чем ↓ длина волны (чем ↑ частота излучения), тем ↑ Е кванта
! Дуализм электрона: (Луи де Бройль, 1924 г., Франция) -
е- характеризуется двойственной (корпускулярно-волновой) природой, т.е. обладает свойствами и частицы и волны.
е- - частица: m, m v е- -волна: λ, ν
уравнениеде Бройля:
l=h/m v,
m – масса е- ; v – скорость движения е-.
Частице с массой m, движущейся со скоростью v, соответствует волна длиной λ.
! Принцип неопределенности - Вернер Гейзенберг (1927г., Германия):
принципиально невозможно определить одновременно положение (координаты) и скорость (импульс) движения микрочастицы с абсолютной точностью.
D х ×D(m v) ³ h/2p,
где D(m v) -неопределенность составляющей импульса,
D х - неопределенность положения частицы.
Чем точнее определяется координата частицы, тем более неопределенным становится ее импульс и наоборот.
Квантовая механика оперирует с вероятностями нахождения частиц, и ничего не говорит о траектории частицы, ее координатах и скорости в тот или иной момент времени.
Вместо выражения «движение е-» используют термин состояние е- (в атоме, молекуле).
! Уравнение Шредингера: (Шредингер 1926 г., Австрия) - математическое описание состояния е- в атоме, основное уравнение квантовой механики.

ψ – волновая функция, описывает пространственные характеристики е-, h – постоянная Планка, U – потенциальная энергия, Е – полная энергия, m – масса, x, y, z –координаты е.-
|ψ|2 - плотностью вероятности.
|ψ|2 dV -вероятность нахождения е- в данном элементарном объеме V.
Из уравнения Шредингера находят полную Е частицы и зависимость функции ψ (и |ψ|2) от координат.
В простейшем случае волновая функция зависит от трех координат y = y (х, у, z) и называется орбиталью.
Распределение вероятности нахождения е- в атоме – облако, плотность которого по всему объему различна.
Орбиталь – область околоядерного пространства, в котором наиболее высока вероятность (˃ 95%) пребывания е-.
Графическое изображение атомной орбитали (АО)
Т. к. е- несет отрицательный заряд, его орбиталь есть определенное распределение заряда - электронное облако.
! Состояние любого е- в атоме определяется 4 - мя квантовыми числами
Поиск по сайту: