 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 17. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ИЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- процессы взаимного превращения химической и электрической форм энергии: Е хим  Е эл
Е эл
особый вид окислительно – восстановительных реакций (ОВР Любая ОВР –
сумма сопряженных реакций окисления и восстановления
4 е -
2Но2 + Оо2 = 2Н+2О-2
восст- ль окисл - ль
Окисление – процесс отдачи е - частицей
Частица, отдающая е - - восстановитель (↑ ст. ок.)
Восстановление – процесс присоединения е - частицей
Частица, принимающая е - - окислитель (↓ ст. ок.)
Условие прохождения реакции:
столкновение частиц и переход е - от восстановителя к окислителю на малом расстоянии между ними
Особенности электрохимических ОВР -
- пространственное разделение процессов окисления и восстановления
- проводятся в электрохимических ячейках
Ячейка состоит из:
- двух электродов (1)
- внутренней цепи (2)
- внешней цепи (3)
проводники II рода-растворы, расплавы электролитов (ионнаяпроводимость)
проводники I рода - металлические проводники (е - - проводимость)
В электрохимии:
процессы восстановления → катодные процессы
процессы окисления → анодные процессы
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
Электрод – проводник I рода, находящийся в контакте с проводником проводником II рода
проводник I рода  проводник II рода
проводник II рода
При погружении Ме в раствор собственных ионов происходит:
1) адсорбция полярных молекул растворителя (Н2О)
2) переход гидратированных катионов в раствор:
Ме + m Н2О ® Mеn+ × (Н2О)m + ne-


раствор Ме
В Ме остаются е -, нескомпенсированные (+) –ионами Þповерхность Ме
заряжается (-), приэлектродный слой раствора заряжается (+)
3) на границе Ме – раствор образуется двойной электрический слой (ДЭС),
который характеризуется определенной разностью потенциалов, называемой электродным потенциалом:
(Y2 - Y1) = Е Меn+/Ме – электродный потенциал 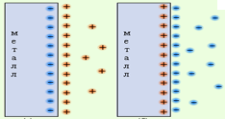
активный металл (Fe, Zn) Þ переход ионов в раствор Þ (- Е)
малоактивный металл (Cu, Ag) Þ адсорбция ионов из раствора Þ(+ Е)
4) При некотором значении Е устанавливается динамическое равновесие:
Ме + m Н2О  Меn+× (Н2О)m+ n e-
Меn+× (Н2О)m+ n e-
Упрощенно:
Ме  Меn+ + nе -
Меn+ + nе -
Потенциал, который устанавливается в условиях электродной реакции - равновесный электродный потенциал (Е равн)
Ионы металла Men+ - потенциалопределяющие ионы
Е равн зависит:
от природы Ме:
чем ¯ Е ионизации атома Ме
чем ¯ Е крист решетки Ме
чем Е гидратации ионов Ме, тем ↑ способность Ме посылать ионы Меn+ в раствори более отрицательным будет его 
от активности потенциалопределяющих ионов
от Т
У благородных Ме: Pt, (Pd, Au):
Е крист. реш. и Е иониз. Þ
нет разности потенциалов, обусловленной переходом ионов
Þ Pt, (Pd, Au) не принимают участия в электродных реакциях.
ü
Их используют в качестве подложки для адсорбции газов в газовых электродах.
ЗАКОНЫ ФАРАДЕЯ
1–й закон. Массы превращенных веществ на электродах при протекании постоянного тока пропорциональны количеству электричества Q, прошедшего через систему.
2-й закон. При прохождении через различные системы одного и того же количества электричества Q массы превращенных веществ m пропорциональны молярным массам их эквивалентов.
m (1) / M Э(1) = m (2) / M Э(2)
Объединенный закон:
При прохождении через любую электрохимическую систему 1F электричества на каждом из электродов превращается 1 моль-эквивалент вещества
F = 96484 Кл или F= 26,8 А×ч - число Фарадея
для массы вещества:

для объема газообразного 
вещества
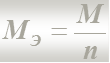 n – число е-, участвующее в процессе
n – число е-, участвующее в процессе
МЭ – молярная масса эквивалента вещества, г/моль

VЭ – объем моль эквивалента газа, л/моль
Q = I×τ - количество электричества [А×с]или [Кл];
I - сила постоянного тока [А];
τ – время процесса, [с]
Поиск по сайту: