 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 26. ОПРЕДЕЛЕНИЕ ВОЗМОЖНОСТИ КОРРОЗИИ И НАДЕЖНОСТИ ВЫБРАННОГО МЕТОДА ЗАЩИТЫ МЕТАЛЛА НА КОНКРЕТНЫХ ПРИМЕРАХ
Пример 1. Определите термодинамическую возможность газовой коррозии изделия из низкоуглеродистой стали (Fe) эксплуатирующегося при 700 К в среде водяного пара (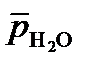 = 10).
= 10).
Решение. Коррозия может быть вызвана процессом:
Fe(т) + Н2О(г) → FeO(т) + Н2(г) и имеет место, если  < 0.
< 0.
Рассчитаем энергию Гиббса процесса:
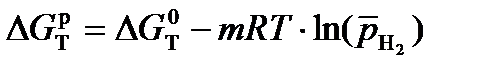


 .
.
Воспользуемся справочными данными:





т.е. газовая коррозия Fe в данных условиях возможна.
Пример 2. Определите относительное парциальное давление водяного пара, при котором прекращается газовая коррозия изделия из низкоуглеродистой стали при 700 К.
Решение. Газовая коррозия прекращается, когда  или
или  . Отсюда:
. Отсюда:
 ;
;
 .
.
Пример 3. Определите температуру, при которой газовая коррозия изделия (пример 1) при стандартных условиях прекратится.
Решение. С некоторыми допущениями температуру, при которой прекращается коррозия, найдем из уравнения:
 , откуда
, откуда  ,
,
т.е. в среде водяного пара газовая коррозия Fe прекращается при Т ≤824 К.
Пример 4. Определите термодинамическую возможность электрохимической коррозии сплава Cu-Zn в водном растворе ZnSO4 c концентрацией соли 0,01 моль/л при 25º С и
 = 0,21, приняв
= 0,21, приняв  = 1. Составьте уравнения процессов, протекающих при коррозии.
= 1. Составьте уравнения процессов, протекающих при коррозии.
Решение. Рассчитаем рН раствора с учетом гидролиза соли, образованной слабым основанием и сильной кислотой [1]:

Равновесные потенциалы возможных окислителей равны:
 ;
;
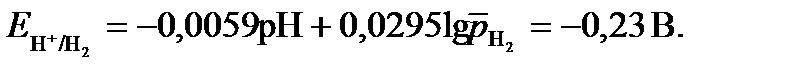
Анодными участками в данном сплаве являются цинковые  <
<  . Так как Е ох>
. Так как Е ох>  , то коррозия данного сплава термодинамически возможна.
, то коррозия данного сплава термодинамически возможна.
Анодный процесс: Zn → Zn2+ + 2 e
Катодные процессы: 2Н+ +2 е → Н2; О2 +4Н+ + 4 е → 2 Н2О.
Пример 5. Выразите скорость равномерной коррозии стального (Fe) изделия через массовый показатель К m, г/(м2·год), если плотность коррозионного тока составляет 0,01 А/м2.
Решение. Из закона Фарадея: m кор.Fe= M э I к t/F. Скорость коррозии равна:
 , где
, где
М э – молярная масса эквивалента, г
F – число Фарадея, 96500 Кл
I к – сила коррозионного тока, А
М эFe = 56/2=28 г/моль.
К m = 
Пример 6. При коррозии железного изделия за 1,5 мин работы коррозионного ГЭ образовалось 0,125 г Fe(OH)2. Вычислите объем кислорода, израсходованного на коррозия железа, силу коррозионного тока и масса растворенного металла.
Решение. Запишем уравнения процессов, протекающих в коррозионном ГЭ:
А: Fe → Fe2+ + 2 e
К: О2 + 2Н2О + 4 е → 4ОН-
Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
n э Fe(OH)2= m Fe(OH)2/ M э Fe(OH)2 = 0,125/45 = 2,8·10-3.
Согласно закону эквивалентов все вещества взаимодействуют в эквивалентных количествах, т.е. n э Fe(OH)2 = n э Fe = n э О2 =2,8·10-3.
Тогда объем кислорода, израсходованного на коррозию железа:
V О2 = n э О2· V э О2 = 2,8·10-3·5,6 = 15,7·10-3 л = 15,7 мл.
По закону Фарадея рассчитаем силу коррозионного тока в ГЭ:
I = V О2· F /(V э О2 · t) = 15,7·10-3·96500/(5,6·90) = 3 А
Определим массу растворившегося Fe:
m Fe = n э Fe · M э Fe = 2,8·10-3·28 = 0,08 г.
Поиск по сайту: