 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ № 15. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролиты – вещества с ионной или ковалентной полярной связью: диссоциирующие в Н2О, др. полярных растворителях или расплавах на ионы и способные проводить электрический ток
Растворы, расплавы электролитов – ионные проводники (II рода):
перенос тока в осуществляется ионами
Металлические проводники (I рода): е-- проводимость
Распад вещества на ионы - электролитическая диссоциация:
ü результат взаимодействия частиц растворяющегося вещества с молекулами растворителя + тепловое (колебательное) движение частиц
ü сопровождается образованием сольватированных ионов
(если растворитель Н2О – ионы гидратированные)
Диссоциация NaCl
ЭО(Cl) = 3,0 ЭО(Na) = 0,9∆ЭО = 2,1 Þ ионная связь
ион – дипольное взаимодействие
NaClк + H2O ® Na+ × aq + Cl– × aq
гидратированные ионы
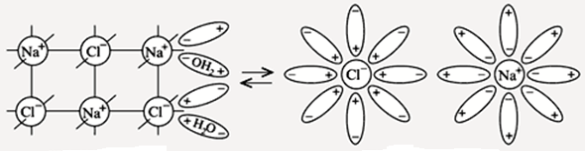
NaCl ® Na+ + Cl–
Диссоциация НCl
ЭО(Cl) = 3,0 ЭО(Н) = 2,1∆ЭО = 0,9 Þ ковалентная полярная связь
диполь – дипольное взаимодействие
НCl + H2O ® Н+ × aq + Cl– × aq
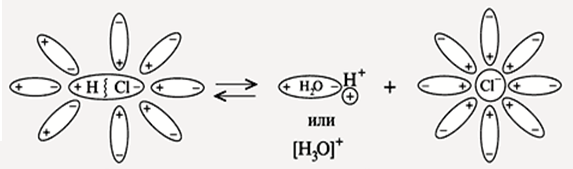
НCl ® Н+ + Cl–
Количественная характеристика диссоциации -
степень диссоциации a:
отношение числа молекул, диссоциированных на ионы (с дис), к общему числу молекул электролита(с о)
a = с дис / с о
a = 0 – неэлектролиты, сдис = 0
a ≈ 1 – сильные электролиты сдис ≈ с 0
a << 1 - слабые электролиты сдис < с 0 (a: 0,03 ÷ 03)
a зависит:
· от природы растворенного вещества
(от строения молекул, химической связи в них, межмолекулярных взаимодействий)
| Вещество, с = соnst | l св, нм | Е св, кДж/моль | a |
| HF | 0,92 | 0,10 | |
| HCl | 1,27 | 0,92 | |
| HBr | 1,40 | 0,95 | |
| HI | 1,60 | 0,98 |
↑ l св, Е св ↓, a ↑
H+ᵟ — F-ᵟ ∙ ∙ ∙ H+ᵟ — F-ᵟ ∙ ∙ ∙ H+ᵟ — F-ᵟ (Н – связи)
· от природы растворителя (величины диэлектрической проницаемости среды ε)
HCl
| растворитель | ε | a |
| Н2О | 80,4 | 0,92 |
| С6Н6 | 2,3 | ≈ 0 |
! Четкой границы между сильными и слабыми электролитами нет
· от температуры
сильные электролиты: с ↑ Т a↓
слабые электролиты: зависимость проходит через максимум (для многих веществ max находится в области 60 0С)
· от концентрации
В водных растворах
Сильные электролиты:
1. кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4 и др.
2. щелочи (гидроксиды s -металлов, кроме Be(OH)2 Mg(OH)2)
3. почти все соли
Слабые электролиты:
1. многие неорганические и органические кислоты
2. основания р -, d - элементов, Be(OH)2, Mg(OH)2) (справочник)
3. NH4OH, амины
4. H2O
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Процесс диссоциации – обратим
Равновесие в растворе слабого электролита характеризуется константой диссоциации
Диссоциация слабой кислоты: НА  Н+ + А-
Н+ + А-
Диссоциации слабого основания: RОН  R+ + ОН–
R+ + ОН–
КД зависит от:
• природы диссоциирующего вещества и растворителя;
• температуры:
С Т Þ КД , т. к. DНдисс> 0
КД – не зависит от концентрации раствора
К25д Þ таблица
Чем ↓ К Д, тем слабее диссоциирует электролит


ЗАВИСИМОСТЬ a от С слабого электролита
муравьиная кислота:
НСООН  НСОО- + Н+
НСОО- + Н+
с о – исходная концентрация кислоты
a – степень диссоциации
закона Оствальда 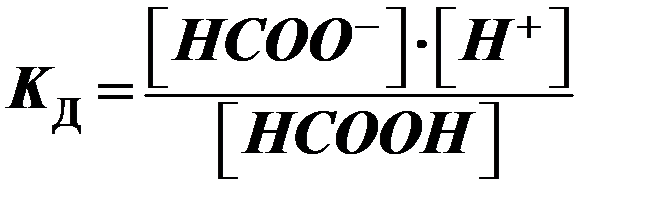


Если a < 0,07, то  - упрощенная формула
- упрощенная формула
 Þ a уменьшается с ↑ концентрации
Þ a уменьшается с ↑ концентрации
Равновесие диссоциации динамическое Þ его можно сместить в ту или иную сторону (ослабить или усилить диссоциацию)
СН3СООН  СН3СОО– + Н+
СН3СОО– + Н+
ü разбавление: равновесие смещается вправо, т. е. a ↑
ü введения одноименного иона:
+ СН3СООNH4 ® СН3СОО– + NH4+
↑ С (СН3СОО–) Þ равновесие смещается влево, т. е. a ¯
+ HCl ® Н+ + Сl–
↑ С (Н+) Þ равновесие смещается вправо, т. е. a ↑
Поиск по сайту: