 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Опыт Франка-Герца
Обобщая результаты опытов, Резерфорд предложил ядерную (планетарную) модель строения атома. Согласно этой модели, весь положительный заряд и почти вся масса атома (99,4%) сосредоточены в атомном ядре. Размер ядра (~10-15 м) ничтожно мал по сравнению с размером атома (~10-10 м). Вокруг ядра по замкнутым эллиптическим орбитам, которые в первом приближении можно считать круговыми, движутся электроны, образуя электронную оболочку атома. Заряд ядра равен суммарному заряду электронов. Однако предложенная Резерфордом модель строения атома не объяснила спектральных закономерностей и даже оказалась в противоречии с законами классической механики и электродинамики. В самом деле, движение электрона по орбите, как и всякое криволинейное движение, есть движение с ускорением. Согласно законам классической электродинамики, криволинейное движение должно сопровождаться излучением света соответствующей частоты. Следовательно, при движении электрона вокруг ядра атом должен непрерывно излучать энергию. Но уменьшение энергии приводит к уменьшению радиуса орбиты электрона электрон должен двигаться по спирали, приближаясь к ядру. А так как скорость движения электрона остается неизменной, то должна увеличиться и круговая частота его вращения, непрерывно должна расти частота излучения, т.е. спектр излучения должен быть сплошным. Непрерывно приближаясь к ядру, электрон через небольшой промежуток времени должен упасть на ядро, т.е. в модели Резерфорда атом является неустойчивой системой. В действительности же атомы являются весьма устойчивыми системами и имеют линейчатые, а не сплошные спектры излучения. Внутреннее строение атома изучать непосредственно невозможно из-за малости размеров атома, линейные размеры которого приблизительно 10-10 м. Структура атома проявляется только косвенно в явлениях, связанных с его внутренним строением. К числу этих явлений относится излучение. При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий. Структуры соответствующих серий, относящихся к различным химическим элементам, схожи между собой. В пределах одной серии расположение спектральных линий имеет определенный порядок. Наиболее простым атомом является атом водорода. В 1885 г. Бальмеру удалось найти формулу, описывающую распределение спектральных линий видимого спектра водорода, получивших название серии Бальмера:
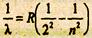 (15.1)
(15.1)
λ - длина волны; 1/λ - волновое число; n для различных линий серии принимает значение последовательного ряда целых чисел, начиная с трех: n = 3,4,5, R = 1,097 107 м-1 - постоянная
Ридберга. Формула (15.1) определяет волну, соответствующую последовательным линиям серии Бальмера, как функцию целого числа. Исследования излучения в невидимой части спектра показали, что существуют серии, расположенные в инфракрасной области: серия Пашена, Брэккета, Пфунда; в ультрафиолетовой области серия Лаймана. Формулы, определяющие расположение спектральных линий в каждой из этих серий, аналогичны формуле для серии Бальмера. Обычно обобщенную формулу Бальмера для всех линий спектра атома водорода записывают в виде:
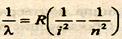 (15.2)
(15.2)
где i и n принимают вполне определенные значения для каждой серии и каждой спектральной линии (табл. 15.1).
Таблица 15.1
| Значение i | Наименование серии | Значение n |
| 1 2 3 4 | Серия Лаймана Серия Бальмера Серия Пашена Серия Брэккета | 2,3,4, 3,4,5, 4,5,6, 7,8,9, |
Учитывая, что λ = c/ν или 1/λ=ν/с, формулу можно, переписать в виде
ν=R'(1/i2–1/n2) (15.3)
[R' = R c = 3,29·1015с-1. (15.4)
Величину R' также называют постоянной Ридберга. При увеличении n длина волны уменьшается, а частота линий увеличивается и достигает предельного значения R/i2 при n → ∞. R/i2 является границей серии. А налогичные спектральные линии имеются не только у водорода, а, например, и у щелочных металлов. Расположение спектральных линий определяется формулой, аналогичной формуле Бальмера. Частота, соответствующая какой-либо спектральной линии этой серии, является разностью двух величин, одна из которых зависит от номера i серии и постоянна для всех линий данной серии, а другая определяется номером n в этой серии. Н. Бор ввел идеи квантовой теории в ядерную модель Резерфорда и разработал теорию атома водорода полностью подтвержденную экспериментально. В основе боровской теории атома лежат два основных положения (постулата).
1. Электроны могут двигаться в атоме только по определенным орбитам, находясь на которых, они, несмотря на наличие у них ускорения, не излучают. Эти орбиты соответствуют стационарным состояниям электронов в атоме и определяются условием:
mе vn rn = nh/2π (15.5)
rn - радиус n-й орбиты; vn - скорость электрона на этой орбите; mе - масса электрона; mevnrn - момент импульса электрона на этой орбите; n - целое число (n ≠ 0).
2. Атом излучает или поглощает квант электромагнитной энергии при переходе электрона из одного стационарного состояния вдругое. Энергия кванта равна разности энергий стационарных состояний электрона до (Е2) и после (Е1) перехода:
hν = E2 -E1. (15.6)
Рассмотрим простейший атом - атом водорода. Он состоит из ядра, в состав которого входит один протон, и одного электрона, вращающегося вокруг ядра по круговой орбите. На электрон со стороны ядра действует кулоновская сила притяжения, сообщая ему центростремительное ускорение, поэтому;
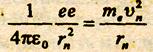 (15.7)
(15.7)
е - заряд электрона и протона, ε0 - электрическая постоянная. Поскольку должен выполняться первый постулат Бора, воспользуемся выражением (15.5). Определим из него скорость vn, возведем в квадрат и подставим в (15.7). Из полученного выражения найдем:
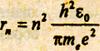 (15.8)
(15.8)
[n=1,2,3, …]. Как следует из соотношения (15.8), радиусы орбит электрона в атоме водорода пропорциональны n2. Подставляя в (7.8) значения констант и считая n = 1, получаем значение первого воровского радиуса, который является единицей длины в атомной физике:
rв = 0,528· 10-10 м.
По боровской модели ядро атома считается неподвижным, поэтому полная энергия Е атома является суммой кинетической энергии Ек вращения электрона и потенциальной энергии Еn взаимодействия электрона с ядром:
 (15.9)
(15.9)
Полученное значение Е отрицательно, так как потенциальная энергия двух зарядов, находящихся на бесконечно большом расстоянии, равно нулю. При сближении зарядов потенциальная энергия уменьшается.
Наименьшей энергией, как следует из уравнения (15.9), атом обладает при n=1. В этом случае говорят, что атом находится в основном энергетическом состоянии. Состояние с n>1 называют возбужденными.
Определим энергию Еn на любом энергетическом уровне. Для этого подставим (15.8) в выражение (15.9):
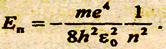 (15.10)
(15.10)
Поиск по сайту: