 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Законы распределения Максвелла и Больцмана
В п. 2.3 мы получили выражение для распределения молекул по скоростям (распределение Максвелла):
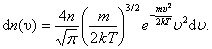
|
Из этого выражения легко найти распределение молекул газа по значениям кинетической энергии K. Для этого перейдём от переменной υ к переменной 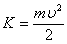 :
:

|
где d n(K) – число молекул, имеющих кинетическую энергию поступательного движения, заключённую в интервале от K до K +d K. Отсюда получим функцию распределения молекул по энергиям теплового движения:
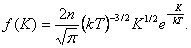
| (2.6.1) |
Средняя кинетическая энергия молекулы идеального газа:
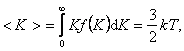
|
то есть получаем результат, совпадающий с прежним результатом, полученным в п. 1.3.
Итак, закон Максвелла даёт распределение частиц по значениям кинетической энергии, а закон Больцмана – распределение частиц по значениям потенциальной энергии. Оба распределения можно объединить в единый закон Максвелла – Больцмана:
 . .
| (2.6.2) |
Здесь n0 – число молекул в единице объёма в той точке, где U = 0, E = U+K – полная энергия.
В последнем выражении, потенциальная и кинетическая энергии, а следовательно и полная энергия Е, могут принимать непрерывный ряд значений. Если же энергия частицы может принимать лишь дискретный ряд значений Е1, Е2 …, (как это имеет место, например, для внутренней энергии атома), то в этом случае распределение Больцмана имеет вид:
 , ,
| (2.6.3) |
где Ni – число частиц, находящихся в состоянии с энергией Ei, а A> – коэффициент пропорциональности, который должен удовлетворять условию

|
где N – полное число частиц в рассматриваемой системе.
Тогда окончательное выражение распределения Максвелла – Больцмана для случая дискретных значений энергий будет иметь вид:
Поиск по сайту: